Poli(2-oksazoliny): Wszechstronna platforma polimerowa dla biomedycyny
Victor R. de la Rosa1, An Van Den Bulcke2, Richard Hoogenboom1
1Supramolecular Chemistry Group, Department of Organic and Macromolecular Chemistry Ghent University, Krijgslaan 281-S4, 9000 Ghent, Belgium, 2ChemTech, Department of Organic and Macromolecular Chemistry, Ghent University Krijgslaan 281-S4, 9000 Ghent, Belgium.
Material Matters, 2016, 11.3
Wprowadzenie
Wprowadzenie polimerów do biomedycyny otworzyło nowe możliwości w inżynierii tkankowej, projektowaniu implantów, biosensingu i dostarczaniu leków. Synergiczne połączenie polimerów i farmaceutyków stanowi sposób na zaspokojenie istotnych niezaspokojonych potrzeb medycznych, takich jak ciągłe długotrwałe uwalnianie leków lub dostarczanie dużych ilości leków do określonych tkanek. Polimery są zatem kluczowym składnikiem w takich obszarach jak leczenie raka, medycyna regeneracyjna i terapia genowa.
Poliglikol etylenowy (PEG), znany również jako poli(tlenek etylenu) lub PEO, jest najczęściej stosowanym polimerem w biomedycynie w celu zwiększenia okresu półtrwania i immunogenności białek. Chociaż PEG pozostaje złotym standardem w zastosowaniach biomedycznych opartych na polimerach ze względu na niską dyspersję (Ð), biokompatybilność i ograniczone rozpoznawanie przez układ odpornościowy (zachowanie stealth), ma pewne wady i ograniczenia. Na przykład, przeciwciała anty-PEG zaobserwowano u znacznej liczby pacjentów,1,2 w tym 25% pacjentów nigdy nie leczonych lekami PEG (ze względu na jego wszechobecność w kosmetykach i dodatkach do żywności). Sugeruje to przyczynę przyspieszonego klirensu koniugatów PEG we krwi po wielokrotnych wstrzyknięciach.3 Ponadto polieterowy szkielet PEG jest podatny na degradację oksydacyjną,4 istotną wadę dla długoterminowych zastosowań, takich jak powierzchnie przeciwporostowe implantów5 i prawdopodobną indukcję aktywacji dopełniacza za pośrednictwem PEG.6-8
Niemniej jednak sukces PEG w zastosowaniach biomedycznych utorował drogę do rozwoju nowej generacji biomateriałów polimerowych, o większej wszechstronności i bardziej zróżnicowanych możliwościach architektonicznych, aby sprostać nowym wyzwaniom w medycynie i wymaganiom w zakresie ładowania leków, reagowania, celowania i znakowania.9-11 Poli(2-alkilo/arylo-2-oksazoliny), powszechnie określane skrótem PAOx, POx lub POZ, zapewniają wyższą stabilność, przestrajalność i funkcjonalizację niż PEG, zachowując jednocześnie wymagane cechy biokompatybilności,12 niewidzialne zachowanie i niską dyspersję. Doskonałe właściwości polimerów PAOx umożliwiają ich wykorzystanie w wielu różnych zastosowaniach biomedycznych, od ukierunkowanego dostarczania leków i formułowania leków po inżynierię tkankową i kleje tkankowe. W szczególności niezwykła wszechstronność syntetyczna PAOx pozwala na budowę złożonych architektur polimerowych o precyzyjnie dostrajalnych właściwościach fizycznych w określony sposób, co czyni je atrakcyjną platformą do opracowywania nowych podejść w medycynie precyzyjnej.13,14 Niniejszy przegląd biomedycznych zastosowań PAOx kładzie szczególny nacisk na ich wkład i potencjalny wpływ na zastosowania związane z dostarczaniem leków.
Właściwości i biokompatybilność
Jak pokazano na rysunku 1, PAOx są łatwo otrzymywane poprzez kationową polimeryzację z otwarciem pierścienia (CROP) 2-oksazolin, w wyniku czego powstają polimery o szkielecie złożonym z trzeciorzędowych amidów, które tłumią interakcje z białkami i powodują znacznie zmniejszone rozpoznawanie przez układ odpornościowy.15
Funkcjonalność może być wprowadzona na obu końcach łańcucha polimerowego poprzez wybór inicjatora elektrofilowego [halogenki alkilowe, halogenki kwasowe, (pluri)tosylany, (pluri)triflany, (pluri)nosylany, itp.] i nukleofilowego czynnika kończącego (aminy, tiolany, karboksylany, itp.). Kontrola funkcjonalności końca łańcucha polimeru pozwala na włączenie jednostek celujących lub radioznaczników do obrazowania, jednocześnie umożliwiając wykorzystanie PAOx do modyfikacji powierzchni lub nanocząstek. Co więcej, łańcuchy boczne można dostrajać poprzez modyfikację podstawnika monomeru 2-oksazoliny, zapewniając kontrolę nad równowagą hydrofilowo-hydrofobową i niższą krytyczną temperaturą roztworu (LCST) polimeru.16 Ta możliwość dostrajania łańcucha bocznego umożliwia wprowadzenie wielu grup funkcyjnych wzdłuż łańcucha polimeru i przygotowanie hydrożeli lub wysoce obciążonych lekami nośników.
Rysunek 2 s przedstawia serię PAOx o rosnącym stopniu hydrofobowości. Podczas gdy poli(2-metylo-2-oksazolina) lub PMeOx wykazuje wyższą hydrofilowość niż PEG,17 PAOx z dłuższymi alkilowymi łańcuchami bocznymi wykazuje zachowanie termoresponsywne z temperaturami przejścia stopniowo obniżającymi się wraz z hydrofobowością łańcucha bocznego polimeru. W przeciwieństwie do złotego standardu termoczułego polimeru do zastosowań biomedycznych, poli(N-izopropyloakryloamidu) (PNIPAM, LCST = 32 °C, nr produktu. 806471), PAOx wykazuje minimalną histerezę termiczną, a temperatura przejścia może być precyzyjnie regulowana przez kopolimeryzację hydrofilowych i hydrofobowych 2-oksazolin.18 Ta regulowalność sprawia, że PAOx jest idealnym polimerem do rozwoju inteligentnych materiałów reagujących na bodźce, z zastosowaniami w wykrywaniu, diagnostyce i wyzwalanym dostarczaniu leków.19-21
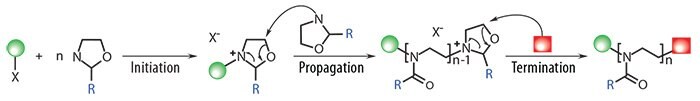
Rysunek 1. Żywa kationowa polimeryzacja z otwarciem pierścienia (CROP) 2-oksazolin. Zarówno końce alfa, jak i omega mogą być funkcjonalizowane poprzez wybór inicjatora (tosylan na schemacie) i czynnika kończącego (nukleofil). Dobrze zdefiniowane kopolimery blokowe są osiągalne poprzez sukcesywne dodawanie monomeru, co skutkuje polimerami o bardzo niskich wartościach dyspersyjności (zazwyczaj Ð = 1,05-1,30).
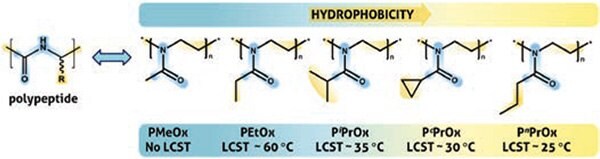
Rysunek 2. Seria pochodnych PAOx wykazuje analogię strukturalną do naturalnych polipeptydów i ich amfifilowy charakter. Dolna temperatura krytyczna roztworu (LCST) może być precyzyjnie regulowana przez kopolimeryzację. PiPrOx i PnPrOx są izomerami strukturalnymi i potencjalnymi alternatywami poli(N-izopropyloakryloamidu) (PNIPAM, LCST = 32 °C).14
Podobieństwo strukturalne PAOx do naturalnych polipeptydów, jak pokazano na Rysunku 2,, odpowiada za ich niewidzialne zachowanie i doskonałą biokompatybilność. PAOx wykazują bardzo szybki klirens krwi i niezwykle niski wychwyt w narządach układu siateczkowo-śródbłonkowego, co wykazano w badaniach biodystrybucji ze znakowanym radioaktywnie PMeOx o masie 5 kDa i poli(2-etylo-2-oksazoliną) lub PEtOx,22 które wykazują pozorną granicę klirensu 40 kDa.23 Toksyczność in vivo nie wykazała niekorzystnych skutków po wielokrotnym dożylnym wstrzyknięciu (u szczurów) PEtOx o masie 10 i 20 kDa w szerokim zakresie stężeń (od 500 do 2000 mg/kg).17 Być może najbardziej uspokajającym przykładem biokompatybilności PAOx jest rozwój pierwszego komercyjnego farmaceutyku opartego na PAOx, który jest obecnie poddawany pierwszym badaniom klinicznym fazy I na ludziach.24
Dzięki doskonałej biokompatybilności i wszechstronności syntetycznej, PAOx cieszą się rosnącym zainteresowaniem jako przyszła platforma dostarczania leków, a znaczący postęp w tej dziedzinie został już osiągnięty. Opracowywane obecnie aplikacje stawiają czoła aktualnym wyzwaniom w zakresie ukierunkowanego dostarczania leków o wysokim stężeniu, terapii skojarzonej, przedłużonego uwalniania leków i formulacji. Główne strategie badane przy użyciu PAOx w dostarczaniu leków zostały podsumowane na Rysunku 3 i można je odróżnić od systemów, w których aktywny składnik farmaceutyczny (API) jest kowalencyjnie lub niekowalencyjnie związany z polimerem.

Rysunek 3. Przegląd głównych strategii oferowanych przez PAOx w zastosowaniach związanych z dostarczaniem leków. Niezwykła zdolność do dostosowywania właściwości materiału oferowana przez PAOx odpowiada za ich zastosowanie w zróżnicowanym zestawie metod dostarczania leków.
Niekowalencyjnie związane dostarczanie leków
PAOx jako substancja pomocnicza w formulacji leków
Prawdopodobnie najprostszym wkładem polimerów w dostarczanie leków jest ich zastosowanie jako substancji pomocniczych, w których API jest zdyspergowane razem z polimerem, który służy jako matryca do poprawy profilu rozpuszczalności leku. Poszukiwanie nowych zaróbek leków jest motywowane słabą rozpuszczalnością w wodzie około 90% nowo opracowanych leków.25 Wytłaczanie na gorąco (HME) lub suszenie rozpyłowe odpowiednich polimerów wraz z API pozwala na tworzenie stałych roztworów, w których lek jest stabilizowany w postaci amorficznej, znacznie zwiększając jego rozpuszczalność i biodostępność.
De Geest i wsp. przygotowali formulacje tabletek metoprololu winianu/PEtOx i fenofibratu/PEtOx za pomocą HME przy użyciu Aquazolu. Zarówno w przypadku hydrofilowego winianu metoprololu, jak i hydrofobowego fenofibratu, profile uwalniania można było przyspieszyć lub spowolnić poprzez zmianę masy molowej polimeru.26 Urbanova i współpracownicy wykazali podobną regulację profilu uwalniania kwasu acetylosalicylowego w stałych dyspersjach z PEtOx.27 Ponadto wykazano, że preparaty PAOx znacznie zwiększają stabilność wrażliwych kannabinoidów, działając znacznie lepiej niż najnowocześniejsze komercyjne polimery.28 Oczekuje się, że niedawno opracowane metody produkcji PAOx o wysokiej masie molowej i niskiej dyspersji29 wymaganej do zastosowań farmaceutycznych przyspieszą wykorzystanie PAOx w formulacji leków.
Systemy micelarne oparte na PAOx
Polimery amfifilowe samoorganizują się w micele lub polimersomy, w których morfologię można wybrać poprzez dostosowanie długości i składu polimeru. Systemy micelarne są korzystne, ponieważ mogą umożliwiać wysokie ładowanie leków o słabej rozpuszczalności w wodzie, co jest wyzwaniem szczególnie w przypadku wielu nowych terapii przeciwnowotworowych. Ponadto, micele korzystają zarówno z pasywnego, jak i aktywnego ukierunkowania, ponieważ mają tendencję do gromadzenia się w tkankach nowotworowych ze względu na zwiększoną przepuszczalność i efekt retencji (EPR), służąc jednocześnie jako platforma do włączenia grup docelowych.
PAOx pozwalają na wysoce zdefiniowaną strukturę i skład polimeru, umożliwiając precyzyjne dostrojenie równowagi hydrofilowo-hydrofobowej polimeru poprzez kopolimeryzację, a tym samym kontrolę wielkości miceli i właściwości uwalniania leku. Większość opisanych systemów micelarnych opartych na PAOx zawiera hybrydową strukturę diblokową PAOx-poliester (PAOx-PE) lub strukturę trójblokową ABA syntetyzowaną przez sekwencyjne dodawanie hydrofilowych i hydrofobowych monomerów 2-oksazoliny.
Zhao i współpracownicy wykorzystali Boc-NH-PEtOx-OH jako makroinicjator do polimeryzacji ε-kaprolaktonu, a następnie sfunkcjonalizowali hydrofilowy PEtOx cząsteczką folianu. Zaowocowało to micelami dekorowanymi folianami, które można było załadować doksorubicyną (DOX, nr produktu D1515) o wydajności wyższej niż 10% wag. Nanowektory te wykazały lepszą skuteczność terapeutyczną i mniejszą toksyczność niż DOX po podaniu nagim myszom z guzami KB.30 Podobny ukierunkowany system miceli został załadowany zielenią indocyjaninową, zatwierdzonym przez FDA barwnikiem bliskiej podczerwieni, umożliwiającym zarówno obrazowanie guza, jak i skuteczną terapię fototermiczną guzów KB in vivo.31
Wielokrotne cząsteczki celujące mogą być włączone do zewnętrznej powłoki miceli w celu zwiększenia wychwytu komórkowego poprzez połączenie różnie sfunkcjonalizowanych PAOx, jak ostatnio opisano dla systemu PEtOx-b-P(d-l-laktyd).32
Bardzo dobrze zbadany system miceli opracowany przez Kabanova, Jordana i Luxenhofera obejmuje trójblokową strukturę ABA z hydrofobowym środkowym blokiem poli(2-n-butylo-2-oksazoliny) lub PBuOx i dwoma zewnętrznymi blokami PMeOx.33 Ten system polimerowy zapewnia stabilne micele o rozmiarach poniżej 100 nm i niezrównaną wysoką zdolność do ładowania leków przeciwnowotworowych o słabej rozpuszczalności w wodzie. W przypadku szeregu taksoidów nowej generacji odnotowano zdolność ładowania do 50 % mas., co zwiększa wewnętrzną rozpuszczalność API nawet 9000 razy.34 W przypadku tych systemów micelarnych o wysokiej pojemności odnotowano również efekty synergetyczne wynikające z łączenia wielu API w micelach.35 Obecnie zespół Kabanova buduje cheminformatyczną bazę danych, aby przewidzieć, które leki mogą najlepiej wykorzystać te nośniki micelarne oparte na PAOx.
Hydrożele na bazie PAOx
Wprowadzenie funkcjonalności w łańcuchu bocznym polimeru pozwala na szeroką gamę strategii przygotowania hydrożeli na bazie PAOx.36,37 Lecommandoux i wsp. wprowadzili reaktywne jednostki aminowe wzdłuż łańcucha PEtOx poprzez częściową hydrolizę. Otrzymane kopolimery PEtOx-PEI zostały następnie usieciowane eterem bis-glicydylowym w środowisku wodnym, w wyniku czego otrzymano biokompatybilne sferyczne nanożele o optymalnym rozmiarze do zastosowań związanych z dostarczaniem leków.38,39 Co więcej, wstrzykiwalne hydrożele oparte na PEtOx-poli(ε-kaprolakton)-PEtOx wykazały lepszą biokompatybilność w porównaniu do komercyjnego Matrigelu® i Pluronic® F127 (Product No. P2443) do wewnątrzgałkowego dostarczania leków in vivo.40
Dargaville et al. kopolimeryzowali MeOx i 2-(dec-9-enylo)-2-oksazolinę, uzyskując hydrofilowe polimery z alkenowymi łańcuchami bocznymi, które zostały sfunkcjonalizowane sekwencją peptydową CRGDSG w celu promowania adhezji komórek. Późniejsze sieciowanie w obecności ditiolu pozwoliło uzyskać przezroczyste hydrożele w sposób jednogarnkowy. Łagodne warunki procesu żelowania pozwoliły na enkapsulację komórek fibroblastów podczas procesu utwardzania za pośrednictwem promieniowania UV, uzyskując trójwymiarowe konstrukcje komórkowo-polimerowe interesujące w inżynierii tkankowej i medycynie regeneracyjnej.41
Koniugaty leków połączone kowalencyjnie
Koniugacja PAOx-lek i PAOx-białko lub PAOksylacja
PAOksylacja wielu białek, takich jak trypsyna, katalaza, albumina surowicy, insulina lub urykaza, dała koniugaty o wydajności podobnej do ich odpowiedników PEGylowanych.42,43 Co ciekawe, stwierdzono, że koniugaty PEtOx-insulina obniżają poziom glukozy we krwi do 8 godzin, czyli cztery razy dłużej niż wolna insulina.17 Kabanov i wsp. sfunkcjonalizowali szereg PAOx zakończonych piperazyną estrem aktywowanym NHS i przygotowali koniugaty peroksydazy chrzanowej.44 Białko zachowało 90% swojej aktywności, a wychwyt komórkowy wzrósł od trzech do sześciu razy w porównaniu do niezmodyfikowanego białka przy użyciu amfifilowego kopolimeru PMeOx- lub PEtOx-b-PBuOx. Podobne kopolimery zastosowano do koniugacji dysmutazy ponadtlenkowej 1 (SOD1), wykazując zwiększony wychwyt neuronalny koniugatu in vitro i skuteczne przejście przez barierę krew-mózg in vivo.45
Wprowadzenie klikalnych grup wzdłuż hydrofilowego łańcucha PMeOx lub PEtOx46 okazało się skuteczną strategią koniugacji białek i leków. Kopolimery MeOx i EtOx z 2-(pent-4-ynylo)-2-oksazoliną lub PynOx zapewniły wiele punktów wiązania do stabilizacji cząstek wirusopodobnych (VLP). Ikosaedryczny VLP został utworzony przez supramolekularny montaż 180 kopii białka płaszcza bakteriofaga Qβ, a jego powierzchnia została ozdobiona grupami azydkowymi przy użyciu estru azydo-N-hydroksysukcynoimidowego. Po katalizowanej miedzią cykloaddycji azydkowo-alkilowej (CuAAC) z kopolimerami PMeOx/PEtOx-ran-PynOx otrzymano VLP owinięte PAOx o wyjątkowo wysokiej stabilności termicznej. Co więcej, wielkość cząstek może być kontrolowana przez długość polimeru i gęstość przyłączenia.47
Serina Therapeutics wykorzystała podobne polimery PEtOx-ran-PynOx do stworzenia jednotygodniowego leku o przedłużonym uwalnianiu rotigotyny do leczenia choroby Parkinsona. Substancja czynna (API) jest połączona z polimerem za pomocą chemii CuAAC typu "click" przy użyciu biodegradowalnej przekładki estrowej, umożliwiając długotrwałe uwalnianie leku, co prowadzi do stałego poziomu w osoczu.48 Polimer ten, o nazwie SER-214, jest obecnie poddawany badaniom klinicznym fazy I i, jeśli zakończą się one sukcesem, stanie się pierwszym zatwierdzonym przez FDA środkiem terapeutycznym PAOx.24
Hoogenboom i in. wprowadzili funkcjonalności estru metylowego w łańcuchu polioksazoliny poprzez kopolimeryzację EtOx z 2-metoksykarbonyloetylo-2-oksazoliną (MestOx).49 Autorzy wykazali, że powstałe funkcjonalności estru metylowego dekorujące łańcuch polioksazoliny stanowią wysoce wszechstronny uchwyt reaktywny, ponieważ szeroką gamę ugrupowań można wprowadzić poprzez bezpośrednie amidowanie aminami. To syntetyczne podejście dodatkowo rozszerza zestaw narzędzi PAOx do przygotowania nowych koniugatów PAOx-lek.50
Przyszłe koniugaty PAOx-API z wieloma lekami z pewnością zostaną ulepszone poprzez dodanie docelowych ugrupowań w łańcuchach polimerowych, takich jak grupy folianowe lub przeciwciała.
Nanocząstki funkcjonalizowane PAOx
Nanocząstki (NPs) są w stanie pomieścić wiele grup funkcjonalnych, zapewniając jednocześnie unikalne właściwości optyczne, elektroniczne lub magnetyczne, a zatem mają ogromny potencjał w naukach biomedycznych, w tym w obrazowaniu i dostarczaniu leków. Po połączeniu z NPs, PAOx tworzą niewidzialną koronę, która zapewnia stabilizację nanocząstek, zapobiega szybkiemu usuwaniu i służy jako niezawodne rusztowanie do wbudowywania związków bioaktywnych. W tym kontekście Benetti i współpracownicy sfunkcjonalizowali PMeOx-OH nitrodopaminą w celu funkcjonalizacji nanokryształów ZnO interesujących z punktu widzenia obrazowania. Funkcjonalizacja za pomocą PMeOx o masie cząsteczkowej 4 kDa pozwoliła uzyskać indywidualnie zdyspergowane nanokryształy o wyjątkowej stabilności do 9 miesięcy.51
Oprócz zapewnienia stabilności i efektu ukrycia NPs, właściwości termoresponsywne PAOx zostały wykorzystane do przygotowania responsywnych lub inteligentnych NPs, które agregują się po zastosowaniu bodźców zewnętrznych.20 Niedawno fluorescencyjne nanocząstki oparte na poliorganosiloksanie zostały sfunkcjonalizowane termoreaktywną poli(2-izopropylo-2-oksazoliną) lub PiPrOx (Rysunek 2). Poniżej 31 ° C nanocząstki PiPrOx wykazują właściwości przeciwporostowe, gdy są rozproszone w pożywce zawierającej surowicę. Jednak ogrzewanie powyżej tej temperatury powoduje adsorpcję białek surowicy na nanocząstkach, odwracalną przez obniżenie temperatury. Strategię tę można zastosować w celu zwiększenia aglomeracji nanocząstek w docelowych komórkach lub narządach poprzez zastosowanie lokalnego ogrzewania.19
Wreszcie, jak zaobserwowano wcześniej w przypadku miceli i koniugatów na bazie PAOx, PAOx może zwiększać przenikanie nanocząstek przez bariery biologiczne. Khutoryanskiy i wsp. wykorzystali PEtOx o masie cząsteczkowej 5 kDa zakończony alkinami do funkcjonalizacji tiolowanych NP krzemionkowych za pomocą chemii tiol-en. Otrzymane NPs wykazywały zwiększone przenikanie przez śluzówkę żołądka świń ex vivo w podobny sposób jak analogiczne PEGylowane NPs.52 Biorąc pod uwagę prostą możliwość dostrajania składu PAOx i równowagi hydrofilowo-hydrofobowej, oczekuje się, że dalszy rozwój przyniesie jeszcze bardziej wydajne nośniki do dostarczania leków o zwiększonej zdolności do przenikania barier biologicznych.
Wnioski i perspektywy
Duża liczba możliwości oferowanych przez polioksazoliny do tworzenia materiałów, które mają wpływ na szeroką gamę zastosowań biomedycznych, jest wyjątkowa dla tej klasy polimerów. PAOx wykazały już doskonałą biokompatybilność i stabilność w wielu niezależnych badaniach, a pierwsze badania kliniczne polioksazoliny na ludziach są w toku. Ze względu na ich różnorodność strukturalną i funkcjonalną oraz wysoką kontrolę i definicję, jaką oferuje polimeryzacja oksazolin, PAOx stanowią bardzo atrakcyjną i wszechstronną platformę do rozwoju systemów dostarczania leków nowej generacji.
Podziękowania
V.R.R. chciałby podziękować Flanders Innovation and Entrepreneurship za wsparcie finansowe.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?