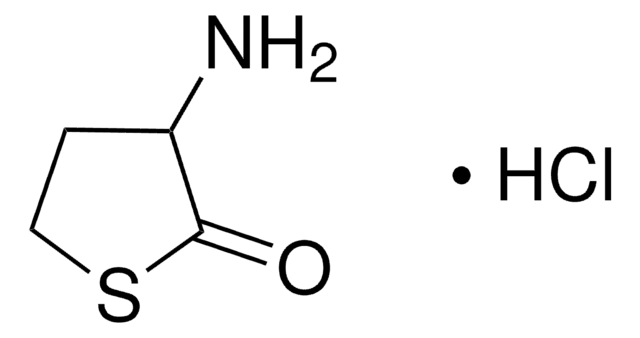
V2501
Snake venom from Vipera russelli (Russell′s Viper)
Zaloguj sięWyświetlanie cen organizacyjnych i kontraktowych
About This Item
Kod UNSPSC:
12352202
Polecane produkty
temp. przechowywania
−20°C
Poziom jakości
Zastosowanie
Jad węża z Vipera russelli (Russell's Viper) został również wykorzystany jako kontrola pozytywna w pośrednim i kanapkowym teście immunoenzymatycznym (ELISA) w celu zbadania wydajności testu immunochromatograficznego (ICT) -Viper w wykrywaniu jadu in vitro i wykrywaniu klinicznego użądlenia.
Jad węża z Vipera russelli (Russell's Viper) został użyty do ekstrakcji białka koagulującego w celu wytworzenia kompleksu z bydlęcym czynnikiem X.
Działania biochem./fizjol.
Jad węża może spowodować śmierć ludzi i zwierząt. Niemniej jednak, jad węża wykazuje również właściwości przeciwbakteryjne i gojące rany. Dlatego też jest stosowany jako środek terapeutyczny w leczeniu różnych chorób, w tym zakrzepicy, zapalenia stawów i raka.
Jad żmii Russella jest bogaty w toksyny i inhibitory proteazy. Receptor z Vipera russelli β-RTX oddziałuje z monoaminami i opiatami oraz zapobiega ich interakcji z natywnymi receptorami. Proteazy ze żmii Russella pośredniczą w krzepnięciu w ludzkim osoczu. Do neurotoksyczności jadu przyczyniają się fosfolipazy.
Ta strona może zawierać tekst przetłumaczony maszynowo.
Kod klasy składowania
11 - Combustible Solids
Klasa zagrożenia wodnego (WGK)
WGK 3
Temperatura zapłonu (°F)
Not applicable
Temperatura zapłonu (°C)
Not applicable
Środki ochrony indywidualnej
Eyeshields, Gloves, type N95 (US)
Wybierz jedną z najnowszych wersji:
Masz już ten produkt?
Dokumenty związane z niedawno zakupionymi produktami zostały zamieszczone w Bibliotece dokumentów.
Snake venom proteins: development into antimicrobial and wound healing agents
PerumalSamy R, et al.
Mini-Reviews in Organic Chemistry, 11(1), 4-14 (2014)
beta-RTX. A receptor-active protein from Russell's viper (Vipera russelli russelli) venom.
Bevan P and Hiestand P
The Journal of Biological Chemistry, 258(8), 5319-5326 (1983)
Characterization and molecular cloning of neurotoxic phospholipases A2 from Taiwan viper (Vipera russelli formosensis)
WANG YM, et al.
European Journal of Biochemistry, 209(2), 635-641 (1992)
Snake Venom Proteinase Inhibitors: II. Chemical Structure of Inhibitor II Isolated from the Venom of Russell's viper (Vipera russelli)
TAKAHASHI H, et al.
Journal of Biochemistry, 76(4), 721-733 (1974)
Coagulation factor X activating enzyme from Russell's viper venom (RVV-X). A novel metalloproteinase with disintegrin (platelet aggregation inhibitor)-like and C-type lectin-like domains.
Takeya H, et al.
The Journal of Biological Chemistry, 267(20), 14109-14117 (1992)
Nasz zespół naukowców ma doświadczenie we wszystkich obszarach badań, w tym w naukach przyrodniczych, materiałoznawstwie, syntezie chemicznej, chromatografii, analityce i wielu innych dziedzinach.
Skontaktuj się z zespołem ds. pomocy technicznej