水溶性かつ生体適合性を有するポリマーは、ミセルから薬物‐ポリマーコンジュゲートに至る薬物送達用製剤における重要なビルディングブロックです。ポリエチレングリコール(PEG)は、薬物送達用製剤に使用される生体適合性を有する不活性ポリマーの標準的な材料として知られています。しかし、薬物の多様性が広がるにつれて、これら薬物に最適な材料特性を持つポリマーの需要が高まっており、生体適合性と多機能性を併せ持つ新規ポリマーの開発が期待されています。
ポリ(2-エチル-2-オキサゾリン)およびポリ(2-メチル-2-オキサゾリン)は、PEGの示す好ましい特性を多く持ちながら1–4、その欠点をいくつか回避できるため、様々な生物医学用途におけるPEG代替材料として広く研究されています(表1)。PEGは薬物送達システムに「ステルス」性を付与することができるため、生物医学用途で広く使用されています。PEG化、つまりバイオ医薬品へのPEGのコンジュゲートによって、複数の医薬品が臨床と市場の両方で成功を収めています。従来、PEGは生体不活性だと考えられていましたが、最近では、PEG‐ウリカーゼ5やPEG‐アスパラギナーゼ6による治療を受けた患者から、PEGに対する血清抗体が検出されています。さらに、ある投与前スクリーニングによると、PEG化医薬品による治療を受けたことがない患者でも、その25%以上の患者に抗PEG抗体がすでに存在していました7,8。これは、化粧品から食品までのさまざまな製品にPEGが大量に使用されていることが原因である可能性があります。さらに、PEG化治療薬を繰り返し投与した動物では、PEG化コンジュゲートが腎臓細胞の空胞化を引き起こすことがあります9,10。
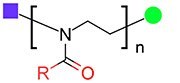
ポリオキサゾリンの構造
ポリ(2-オキサゾリン)はその生体適合性のため、PEGの有力な代替材料となる可能性があります。例えば、ポリオキサゾリンの放射性標識によって、このポリマーが腎臓によって急速に排出され、体内に蓄積しないことが示されています11,12。さらに、ポリ(2-エチル-2-オキサゾリン)やポリ(2-エチル-2-オキサゾリン)ブロック共重合体を使用したin vitro研究では、これらポリマーがPEGより高濃度でも生体適合性を示すことが報告されています13,14。これらの理由から、ポリ(2-オキサゾリン)は、薬物‐ポリマーコンジュゲート(POZylation)15,16、ミセル17、リポソーム二重層へのグラフト18など、様々な製薬および医学用途で研究されています。
PEGの代替材料としての魅力以外にも、ポリ(2-エチル-2-オキサゾリン)ポリマーは、水溶液中で下限臨界溶液温度(LCST:lower critical solution temperature)挙動を示し、その転移温度が人の体温に近いため、バイオメディカル・アプリケーションのための熱応答性材料として使用することができます19-21。ポリ(2-オキサゾリン)は、他の様々な生体にヒントを得た方法(bio-inspired method)やポリマー治療薬にも使用されています22-23。特に、クリック可能なアルキン末端ポリ(2-オキサゾリン)製品は、ウイルス様構造やペプチドポリマー複合材だけでなく、複雑でよく制御されたポリマー構造(シクロデキストリンコア・スターポリマーを含む)の構築のための汎用性の高いビルディングブロックとして使用されています19,24,25。
掲載誌
「ドラッグデリバリーにおける高分子科学の手法 Polymeric Drug Delivery Techniques」
まとめてご覧になりたい方のためにPDFをご用意しています。
関連製品
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?