Tyler Lieberthal, W. John Kao
Biomedical Engineering, Surgery, and Pharmaceutical Sciences, University of Wisconsin-Madison, Madison, WI 53705 USA
Polymeric Drug Delivery Techniques(ドラッグデリバリーにおける高分子科学の手法), 2015, p.31
はじめに
ハイドロゲルは、タンパク質や低分子などの医薬品を時間と空間を制御して放出することを可能にする局所的な投与のための担体として魅力的な材料です。ハイドロゲルは、薬物の局所的な濃度を高く維持することで薬物の全身投与を不要にし、時間の経過とともに薬物を徐放するためのリザーバー(容器)を提供します。ポリ(エチレングリコール)(PEG:poly(ethylene glycol))は親水性ポリマーで、架橋して水で膨潤させると、薬物や細胞をカプセル化することが可能な3次元(3D)ハイドロゲルになります。そのため、PEGハイドロゲルは薬物送達や組織工学向けのプラットフォームとして広く研究されています。PEGハイドロゲルは、非毒性で、生体適合性と生物付着に対する抵抗性があり、生分解性はありません1。さらに、ホスト-材料の相互作用が良好なため、薬物送達の理想的な担体になりえます。また、PEGハイドロゲルの機械的性質は明確であり、PEGの分子量と架橋密度を変えることで、薬物送達部位や薬物の拡散の速度論など、用途に合わせて機械的性質を調節することが可能です2。PEGを修飾することで、PEGハイドロゲルの化学的および機械的な性質をさらに大きく変化させることが可能です。おそらく最も単純な修飾は、フリーラジカル的な付加を介して架橋構造を形成することができるアクリル化でしょう(図1)。
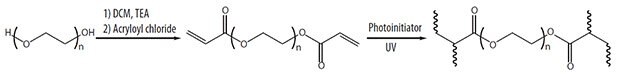
図1PEGジアクリラートハイドロゲルの合成
PEGハイドロゲルの薬物送達への応用
ハイドロゲルからの薬物送達は、カプセル化された医薬品がゲルの本体を通過して、隣接する送達部位の周囲の微小環境へ拡散することで行われます。ハイドロゲルと薬物の多孔性、親水性、その他の物理化学的性質に応じて、循環時間を延長するよう薬物動態的に制御して、充填された薬物を時間の経過とともにゆっくりと溶出させることが可能です5。薬物送達用のPEG系ハイドロゲルには、低分子6、高分子7、ナノ粒子およびマイクロ粒子8–9などの多様な物質が使われています。これらの製剤は、皮膚、目、心臓などの多様な組織に適用されています。
PEGハイドロゲルは「生物不活性」な薬物送達プラットフォームと表現されますが、細胞外マトリックスアミノ酸モチーフやコラーゲンのような高分子などの生物活性材料を組み込むことも可能です10。生体系高分子を組み込むことで、ラミニン、フィブロネクチン、コラーゲン、ヒアルロン酸などの細胞外マトリックス成分の細胞-インテグリン間の認識により、天然組織への統合が促進されます。これは、ハイドロゲルの分解とそれによる薬物放出がホストの微小環境によって影響されるような薬物送達への応用において重要になる場合があります。したがって、ハイドロゲルの組成と分解性部位の分解しやすさによって、分解性を高度に制御することができます。
PEGと生体材料の相互侵入ネットワーク
コラーゲンのような生物由来のハイドロゲルは機械的安定性が不十分なため、機械的強度とin vivoでの寿命の向上に向けてポリマーマトリックスへのPEGの組み込みが多く検討されています。相互侵入ネットワーク(IPN:interpenetrating network)は非常によく用いられており、二つの成分を選択することでハイドロゲルの物理的および生物学的な特性を精密に制御できます。合成材料と生体材料の融合は、物理的からみ合いと共有結合性の架橋のいずれによって行うこともできます。複数の研究グループが、軟骨組織、皮膚組織、声帯ひだ、およびその他の軟組織における活性の向上と細胞の増殖の促進のため、IPNでヒアルロン酸を分解性PEGハイドロゲルに組み込んでいます11–12。通常、分解を促進するため、これらの組成物においてPEGはポリ乳酸または類似の共重合体で修飾されます。また、甲殻類の殻に由来する天然の多糖で、創傷治癒用途によく使用されるキトサンを用いることもできます13。
コラーゲンから処理されたゼラチンのシステインコンジュゲート(Gel-PEG-Cys)とPEGジアクリラート(PEGdA)からなる、堅牢で多用途性に優れたIPNプラットフォームが開発されています(図2)14–15。このIPNの両成分であるゼラチンとPEGdAはチオール-エン反応で互いにin situで架橋されますが、この架橋はUV照射下でも非照射下でも行うことができます。物理的にからみあったゼラチンのネットワークおよび架橋されたPEGdAと比較して、IPNでは機械的特性が改善されます。固定されたゼラチンのみの弾性率が約0.1 MPaであるのに対して、IPNの弾性率はゼラチン対PEGの比率に応じて1~360 MPaの範囲で制御できます16。in vivoでの分解は、ゼラチン:PEGdAの比率、ゼラチンのブルーム強度、チオール修飾の濃度および割合、PEGdAの濃度および分子量、開始剤の重量パーセントなどの複数のパラメータを調節することで、さらに変化させることが可能です17。このIPNバイオマトリックスは、線維芽細胞、ケラチノサイト、間葉系ストロマおよび幹細胞などの多様な種類の細胞や、ミノサイクリン、スルファジアジン銀、ブピバカインなどの低分子量の薬物、そしてペプチドや成長因子のような生物製剤のカプセル化に使用されています14,18–21。さらに、このIPNは、特定部位への送達のために他の薬物または合剤と組み合わせることが可能なプラットフォームとして使用できます。
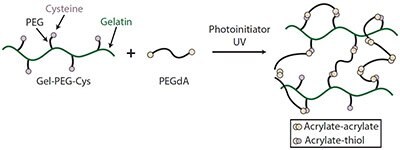
図2システインがコンジュゲーションされたゼラチンとPEGジアクリラートで構成される相互侵入ネットワーク
【プロトコール】UV重合を用いたPEG-ゼラチンIPNハイドロゲルの調製
以下の手順によって、ポリ(エチレングリコール)ジアクリラートとシステインがコンジュゲーションされたゼラチンとを含むIPNハイドロゲル5 mLが得られます。IPNに他の成分を添加する場合、IPNへ組み込む前に、適切な濃度で追加成分の溶解度を決定する必要があります。表1に記載されているように、幅広い生物活性のある化合物がこの調製法によって検討され、適用可能であることが確認されています。また、ハイドロゲルに細胞を組み込む場合は、細胞の生存性も評価する必要があります。ハイドロゲルの組成は、PEGジアクリラート(PEGdA)溶液と修飾されたゼラチン-Cys(Gel-PEG-Cys)溶液を量を変えて混合することにより変化させることが可能です(手順5)。
- 5.0 mLのH2Oを5 mgの光開始剤(410896)が入ったバイアルに加え、0.1%光開始剤溶液を作ります。
- 光開始剤溶液を60℃に加熱して、溶解するまで適宜ボルテックスします。その後、光開始剤溶液を37℃に戻します。
- 任意の水溶性因子(成長因子、低分子、その他の高分子)を所定の濃度で光開始剤溶液に加えます(材料一覧は表1を参照)。
- EncapGel-UV Kit, photo-crosslinkable sIPN hydrogel kit(799610)のPEGdAとGel-PEG-Cysのバイアルを室温に戻します。
- ピペットを使用して、2.5 mLの光開始剤溶液をGel-PEG-Cysのバイアルに入れ、2.5 mLの光開始剤溶液をPEGdAのバイアルに入れます。溶液を37°Cに加熱し、ピペットで上下させて緩やかに混合します。
- PEGdA溶液をGel-PEG-Cys溶液に加え、ピペットで上下させて緩やかに混合します。
- ピペットでハイドロゲル溶液を任意の型または場所に入れます。
- 長波長UVランプ(CF1,000 LED、λmax = 365 nm、Clearstone Technologies, Minneapolis, MNまたは同等のランプ)の下で、約3分間ハイドロゲルを重合させます。
【プロトコール】UV重合を行わないPEG-ゼラチンIPNハイドロゲルの調製
この調製法ではネットワークを架橋するための光開始剤ないしはUV暴露が不要であり、UVの影響を受けやすいことがわかっている生物活性物質を充填する場合に最適な方法です。架橋は、pHが塩基性に変化すると起きるチオールとアクリレートの間のマイケル付加反応によって進行します22。
- 任意の水溶性因子(成長因子、低分子、その他の高分子)を希望する濃度で滅菌水に加えます。
- 水溶液を37℃に加熱します。
- EncapGel-Cx Kit, chemically crosslinkable sIPN hydrogel kit(799629)のPEGdAとGel-PEG-Thiolのバイアルを室温に戻します。
- ピペットを使用して、2.5 mLの水溶液をGel-PEG-Thiolのバイアルに入れ、2.5 mLの水溶液をPEGdAのバイアルに入れます。溶液を37°Cに加熱し、ピペットで上下させて緩やかに混合します。
- PEGdA溶液をGel-PEG-Thiol溶液に加え、ピペットで上下させて緩やかに混合します。
- 1N NaOHでpH 8.5に滴定します。
- ピペットでハイドロゲル溶液を任意の型または場所に素早く入れます。
- 3分間以内にPEGdA/Gel-PEG-Thiolゼラチンハイドロゲルが重合します。
表1 材料一覧 |
|---|
本論文の翻訳は山形大学 落合文吾教授に監修いただきました。御礼申し上げます。
掲載誌
「ドラッグデリバリーにおける高分子科学の手法 Polymeric Drug Delivery Techniques」
まとめてご覧になりたい方のためにPDFをご用意しています。
関連製品
EncapGel関連製品
PEGジアクリラート
PEGジメタクリラート
PEG共重合体
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?