Sangeetha Krishnamurthy,1 Juliana M. Chan2
School of Chemical and Biomedical Engineering1,2 and Lee Kong Chian School of Medicine2, Nanyang Technological University, Singapore
Polymeric Drug Delivery Techniques(ドラッグデリバリーにおける高分子科学の手法), 2015, p.14
はじめに
この10年の間に、ナノ粒子を基盤とするプラットフォームの薬物送達への応用が非常に注目されるようになりました。ナノ粒子を使用した送達では、複数の薬物の担持、標的化配位子による修飾、薬物の血中滞留時間の延長や非特異的毒性の抑制が可能になるなど、従来の薬物送達に対して多くの利点が得られます。高分子ナノ粒子、リポソーム、デンドリマー、金ナノ粒子、カーボンナノチューブ、量子ドットなどのナノ粒子製剤が広く研究されていますが、臨床段階に進んでいる例はわずかです1。
リポソームと高分子ナノ粒子はその本質的な特長のため、薬物送達プラットフォームの中で最もよく研究されています。例えば、リポソームは生体適合性に優れており2、高分子ナノ粒子は安定性と薬物の担持容量に優れています3。大多数の高分子ナノ粒子は臨床応用までまだ数年を要しますが、脂質-ポリマーハイブリッドナノ粒子(LPN:lipid-polymer hybrid nanoparticle)4として知られるハイブリッドタイプの設計により、生体適合性と薬物担持量に関する2つのプラットフォームの利点を組み合わせることが模索されています。
典型的なLPNはコアシェル構造を有し、低分子薬物や診断用分子などのcargo(輸送物)を搭載する高分子コアと、その周囲を取り囲む生体適合性を向上させるための脂質シェルからなります。コアに最も広く使用されているポリマーは、生体適合性、生分解性、一般的な薬物担持の多用途性に優れたpoly(lactic-co-glycolic acid(PLGA)です5,6。シェルには、ホスファチジルコリン、1,2-dilauroyl-sn-glycero-3-phosphocholine、1,2-distearoyl-sn-glycero-3-phosphoethanolamine(DSPE)、コレステロール、ミリスチン酸、ステアリン酸、1,2-dipalmitoyl-sn-glycero-3-phosphocholineなどの脂質や、ポリ(エチレングリコール)(PEG)脂質コンジュゲートなどが使用されています5,7。
脂質-ポリマーハイブリッドナノ粒子(LPN)の一段階合成
従来は、様々な二段階合成法が使用されており(図1B)、脂質ベシクルと高分子ナノ粒子を個別に合成してから混合する必要がありました8。この方法では、二重または多重層の脂質シェルを持つLPNが得られます。リポソームシェルと高分子ナノ粒子コアを融合する方法として、押出法、超音波処理、直接水和、ボルテックス、高圧ホモジナイズなどが使用されています。
Zhangらが最初に示したように、より簡便な一段階合成法では、ナノ沈殿法と脂質およびポリマー成分の自発的な自己組織化を用いて(図1A)、脂質単層シェルで被覆されたLPNが得られます9。この方法では、ポリマーとcargoを有機相(水混和性有機溶媒)に溶解し、脂質を水相に溶解します。水相を撹拌し続けながら有機相を滴下して加え、室温で自己組織化させます。私たちが知るかぎり、この方法は現在利用可能なLPN合成法の中で最も簡単な手法です。
他にも、有機相(水不混和性有機溶媒)中のポリマーと、水相に分散させた脂質との乳化により、LPNを合成することができます。この方法では、有機相と水相を混合して超音波処理し、ポリマーを液滴に分散して脂質単層でポリマーを被覆します。緩やかに撹拌しながら有機溶媒をゆっくり蒸発させた後、LPNを精製します。
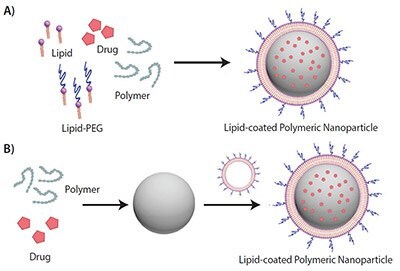
図1一段階および二段階のLPN合成を示した略図。A) 一段階合成法。B) 二段階合成法。
LPN製剤は、標的となる特定部位にcargoを効率的に送達するための修飾を行うことができます。多くの場合、脂質シェルは、EDC-NHSやチオ‐マレイミド化学反応などの単純なコンジュゲーション法を用いて修飾します。例えば、Aravindらが開発したLPNでは、ヌクレオリン受容体を過剰発現しているがん細胞を特異的に標的にするため、脂質シェルに結合したAS1411抗ヌクレオリンアプタマーを含んでいます10。他の例として、ClawsonらはpH応答性の脂質-コハク酸-mPEGでコーティングされた刺激応答性LPNを開発しています11。低pHの腫瘍微小環境でPEG層が分解することで、LPNが細胞膜と融合して内部移行します。
高分子コアは様々なcargoを担持できる(一度に2種類以上の場合もあります)と考えられていますが、脂質シェルもcargoの担持に使用することができます。Senguptaらは、DSPE-PEG、ホスファチジルコリン、コレステロールを含む脂質シェルに、血管新生抑制剤のコンブレスタチン-A4を充填しました。腫瘍部位では、最初にコンブレスタチン-A4が放出されて腫瘍血管系を遮断します。その後、高分子コアからドキソルビシンが放出され、がん細胞傷害性を引き起こします12。
要約
LPNは、ドセタキセル13、パクリタキセル14、クルクミン15、ドキソルビシン16などの薬物のみならず、様々な疾病の徴候に対する診断用分子の送達にも使用されています。LPNは、複数の薬物を担持できることや、薬物充填および薬物放出の精密な制御、標的部位に対する特異的かつ親和性の高い分子による修飾が可能などの特長を有することから、薬物送達用材料の理想的な候補になっています。
LPNは、従来二段階合成法で調製されてきましたが、本稿では簡便で再現性の高い一段階合成法を紹介します。この方法では、サイズの多分散度が低く、物理化学的性質が精密に制御されたLNPを得ることができます17。
LPNの一段階合成法の事例
以下に記述する手順は、Nanyang Technological UniversityのJuliana Chan教授の研究グループで行われている一段階合成法です。
LPNは、自己組織化と組み合わせた一段階ナノ沈殿法を使用して、大豆レシチン、DSPE-PEG、PLGAから合成されます。
- 水溶液は、ガラスバイアル中で4%エタノール水溶液に以下の材料を加えて調製します。
- 90~95%のホスファチジルコリンからなる大豆レシチン(MP Biomedicals, Solon, OH)
- DSPE–PEG2000–COOH(1,2-distearoyl-sn-glycero-3-phospho ethanolamine-N-carboxy(polyethylene glycol)2000)(Avanti, Alabaster, AL 製品番号: 880135P)
- 有機溶液は、アセトニトリルなどの水混和性有機溶媒に以下の材料を加えて調製します。
- モノマー比50:50、エステル末端、粘度0.72~0.92 dl/gのPLGA(Durect Corporation, Pelham, AL)。モノマー比や粘度を変えることで、様々なサイズ、生分解速度、薬物の担持および放出特性のLNPが得られます。
- ドセタキセルなどの低分子薬物
- 水溶液をホットプレートスターラー上で緩やかに撹拌しながら、3~5分間で65℃に加熱します。
- 反応温度に到達したら、水溶液を緩やかに撹拌しながら有機溶液を滴下した後、直ちに3分間激しくボルテックスします。
- 混合物を再び緩やかに撹拌しながら、室温で2時間、LPNを自己組織化させます。
- 分子量カットオフ10 kDaでアミコンウルトラ(Amicon Ultra)‐ 4遠心フィルター(Millipore, Billerica, MA)を使用して、LPNを3回洗浄します。洗浄したLPNを、適切な濃度になるように水またはバッファー中に再懸濁させます。
- LPNは直ちに使用するか、一晩であれば4℃で保管し、長期保管には–80℃で凍結乾燥します。
掲載誌
「ドラッグデリバリーにおける高分子科学の手法 Polymeric Drug Delivery Techniques」
まとめてご覧になりたい方のためにPDFをご用意しています。
関連製品
PEG化リポソーム(Powder)
PEG化リポソーム(分散液)
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?