おすすめの製品
タイプ
Type I
形状
ammonium sulfate suspension
比活性
≥40 units/mg protein
分子量
310-350 kDa
UniProtアクセッション番号
保管温度
2-8°C
遺伝子情報
cow ... GLUD1(281785)
類似した製品をお探しですか? 訪問 製品比較ガイド
生物化学的/生理学的作用
ウシ型を含め、哺乳類型の本酵素は、補酵素としてNADP(H)またはNAD(H)のいずれかを使用できます。L-グルタミン酸デヒドロゲナーゼは、哺乳類の代謝においてユニークな役割を果たします。この酵素によって触媒される逆反応はアンモニアがα-カルボン酸のα-炭素原子に結合できる唯一の経路であるため、哺乳類種におけるde novoアミノ酸合成の唯一の供給源です。
ウシ酵素は、以下の3つの特徴を有しています:
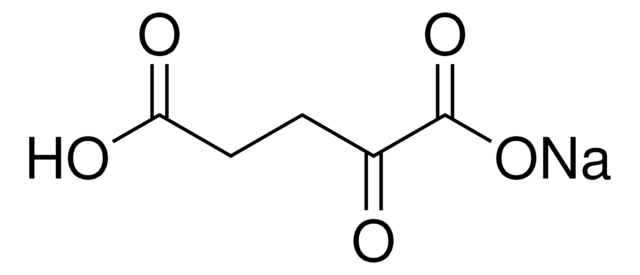
L-グルタミン酸デヒドロゲナーゼは、グルタミン酸のα-ケトグルタル酸への変換を触媒します。
ウシ酵素は、以下の3つの特徴を有しています:
- 可逆的かつ濃度依存的に会合し、高分子量型を生成します。
- 解離速度が定常状態反応速度を調節する、堅固な酵素‐還元型補酵素‐基質の三元複合体を生成します。
- 多数のヌクレオチド修飾因子のいずれかが結合することにより、様々な効果を示します。
L-グルタミン酸デヒドロゲナーゼは、グルタミン酸のα-ケトグルタル酸への変換を触媒します。
L-glutamic dehydrogenase catalyzes the conversion of glutamate to α-ketoglutarate.
単位の定義
1ユニットは、アンモニウムイオン存在下で、pH 7.3、25°C、1分間で、1.0 μmolのα-ケトグルタル酸をL-グルタミン酸に還元する酵素量です。
物理的形状
2.0 Mの(NH4)2SO4溶液(pH 7.0)で調製した懸濁液
アナリシスノート
タンパク質はBiuret法で測定。
基質
製品番号
詳細
価格
シグナルワード
Danger
危険有害性情報
危険有害性の分類
Resp. Sens. 1
保管分類コード
11 - Combustible Solids
WGK
WGK 3
引火点(°F)
Not applicable
引火点(℃)
Not applicable
個人用保護具 (PPE)
Eyeshields, Gloves, type N95 (US)
適用法令
試験研究用途を考慮した関連法令を主に挙げております。化学物質以外については、一部の情報のみ提供しています。 製品を安全かつ合法的に使用することは、使用者の義務です。最新情報により修正される場合があります。WEBの反映には時間を要することがあるため、適宜SDSをご参照ください。
Jan Code
G2501-VAR:
G2501-BULK-N:
G2501-VAR-N:
G2501-1G:
G2501-100MG:
G2501-BULK:
G2501-50MG:
G2501-20MG:
試験成績書(COA)
製品のロット番号・バッチ番号を入力して、試験成績書(COA) を検索できます。ロット番号・バッチ番号は、製品ラベルに「Lot」または「Batch」に続いて記載されています。
この製品を見ている人はこちらもチェック
Michisuke Yuzaki
The European journal of neuroscience, 32(2), 191-197 (2010-07-22)
Several C1q family members, especially the Cbln and C1q-like subfamilies, are highly and predominantly expressed in the central nervous system. Cbln1, a member of the Cbln subfamily, plays two unique roles at parallel fiber (PF)-Purkinje cell synapses in the cerebellum:
Cleanthe Spanaki et al.
Neurotoxicity research, 21(1), 117-127 (2011-11-01)
Glutamate dehydrogenase (GDH) catalyzes the reversible inter-conversion of glutamate to α-ketoglutarate and ammonia. High levels of GDH activity is found in mammalian liver, kidney, brain, and pancreas. In the liver, GDH reaction appears to be close-to-equilibrium, providing the appropriate ratio
Shanti Balasubramaniam et al.
Journal of pediatric endocrinology & metabolism : JPEM, 24(7-8), 573-577 (2011-09-22)
Hyperinsulinism-hyperammonemia syndrome (HI/HA) (OMIM 606762), the second most common form of congenital hyperinsulinism (CHI) is associated with activating missense mutations in the GLUD1 gene, which encodes the mitochondrial matrix enzyme, glutamate dehydrogenase (GDH). Patients present with recurrent symptomatic postprandial hypoglycemia
Nayla Munawar et al.
Extremophiles : life under extreme conditions, 16(3), 463-476 (2012-04-25)
Enzymes produced by halophilic archaea are generally heat resistant and organic solvent tolerant, and accordingly important for biocatalytic applications in 'green chemistry', frequently requiring a low-water environment. NAD(+)-dependent glutamate dehydrogenase from an extremely halophilic archaeon Halobacterium salinarum strain NRC-36014 was
Glutamic dehydrogenase.
H J STRECKER
Archives of biochemistry and biophysics, 46(1), 128-140 (1953-09-01)
資料
Instructions for working with enzymes supplied as ammonium sulfate suspensions
ライフサイエンス、有機合成、材料科学、クロマトグラフィー、分析など、あらゆる分野の研究に経験のあるメンバーがおります。.
製品に関するお問い合わせはこちら(テクニカルサービス)