Alle Fotos(1)
Wichtige Dokumente
TRYPSEQ-RO
Roche
Trypsin in Sequenzierqualität
from bovine pancreas
Synonym(e):
Trypsin
Anmeldenzur Ansicht organisationsspezifischer und vertraglich vereinbarter Preise
Alle Fotos(1)
About This Item
Empfohlene Produkte
Biologische Quelle
bovine pancreas
Qualitätsniveau
Form
lyophilized (salt-free)
Spezifische Aktivität
≥80 units/mg protein
Mol-Gew.
Mr 23.5 kDa
Verpackung
pkg of 4 × 100 μg (11047841001)
pkg of 4 × 25 μg (11418475001)
Hersteller/Markenname
Roche
Optimaler pH-Wert
8.0
Lagertemp.
2-8°C
Verwandte Kategorien
Allgemeine Beschreibung
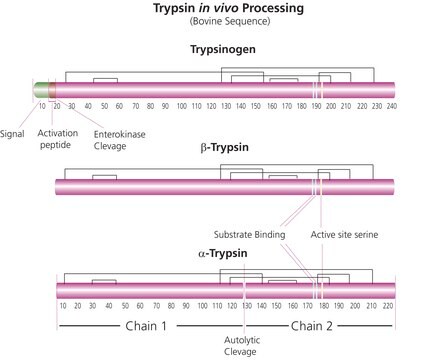
Trypsin in Sequenzierqualität wird aus der Bauchspeicheldrüse von Rindern als hochreine und spezifische Protease isoliert. Trypsin in Sequenzierqualität ist eine Serin-Endopeptidase. Sie spaltet spezifisch Peptidbindungen auf der Carboxyl-Seite der basischen Aminosäuren Arg und Lys. Amid- und Ester-Bindungen von Arg und Lys werden ebenfalls gespalten.
Spezifität
Die Spezifität von Trypsin in Sequenzierqualität wird mit der oxidierten B-Kette von Insulin (Insulin Box) als Substrat verifiziert. Hohe Konzentrationen von Trypsin in Sequenzierqualität (1 Gewichtsteil Enzym und 18 Gewichtsteile Insulin Box) werden 18 Stunden inkubiert, um Spuren von Chymotrypsin-Verunreinigungen nachzuweisen.
Spezifität (HPLC, mit Insulin Box):
Spaltung nach 1 Stunde: ≥90 %
Unspezifische Spaltungsprodukte nach 18 Stunden: ≤10 %
Spezifität (HPLC, mit Insulin Box):
Spaltung nach 1 Stunde: ≥90 %
Unspezifische Spaltungsprodukte nach 18 Stunden: ≤10 %
Anwendung
Trypsin in Sequenzierqualität wird zum Verdau von Proteinen in Lösung, in Gelen oder auf Blotting-Membranen verwendet.
Das Enzym wird zur Aufklärung von Proteinstrukturen, für tryptisches Mapping, Fingerprinting, Sequenzanalysen und für Translokationsstudien genutzt. Trypsin in Sequenzierqualität erzeugt Glykopeptide aus aufgereinigten Glykoproteinen und ist geeignet für den Verdau von Proteinen in Polyacrylamidgelen.
Das Enzym wird zur Aufklärung von Proteinstrukturen, für tryptisches Mapping, Fingerprinting, Sequenzanalysen und für Translokationsstudien genutzt. Trypsin in Sequenzierqualität erzeugt Glykopeptide aus aufgereinigten Glykoproteinen und ist geeignet für den Verdau von Proteinen in Polyacrylamidgelen.
Qualität
Reinheit: Frei von Verunreinigungen, die mit der Separation von Peptiden in der RP-HPLC interferieren können.
Angaben zur Herstellung
Stabilisatoren: Trypsin ist stabil in 4 M.
Arbeitskonzentration: 1/100 bis 1/20 des Proteins nach Gewicht (in Lösung); 1–5 μg/100 μL (für In-Gel-Verdau)
Lagerbedingungen (Arbeitslösung): Eine Lösung in 0,01 % Trifluoressigsäure (TFA), (v/v) oder 1 mM HCl kann maximal eine Woche lang verwendet werden, wenn sie bei 2 bis 8 °C gelagert wird. Durch Inkubation von Proteinen in Lösung bei neutralen bis leicht basischen pH-Werten kann eine Teilautolyse auftreten. Für diese Anwendung empfiehlt Roche modifiziertes Trypsin in Sequenzierqualität.
Arbeitskonzentration: 1/100 bis 1/20 des Proteins nach Gewicht (in Lösung); 1–5 μg/100 μL (für In-Gel-Verdau)
Lagerbedingungen (Arbeitslösung): Eine Lösung in 0,01 % Trifluoressigsäure (TFA), (v/v) oder 1 mM HCl kann maximal eine Woche lang verwendet werden, wenn sie bei 2 bis 8 °C gelagert wird. Durch Inkubation von Proteinen in Lösung bei neutralen bis leicht basischen pH-Werten kann eine Teilautolyse auftreten. Für diese Anwendung empfiehlt Roche modifiziertes Trypsin in Sequenzierqualität.
Rekonstituierung
Für die Stabilität der Lösung ist die Rekonstituierung in Säure erforderlich: Empfohlen werden 0,01 % TFA (v/v), 1 mM HCl oder 0,1 Essigsäure.
Sonstige Hinweise
Nur für die Life-Science-Forschung. Nicht zur Verwendung in diagnostischen Verfahren vorgesehen.
Signalwort
Danger
H-Sätze
Gefahreneinstufungen
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Zielorgane
Respiratory system
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 1
Flammpunkt (°F)
does not flash
Flammpunkt (°C)
does not flash
Hier finden Sie alle aktuellen Versionen:
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Saeedreza Vessal et al.
Journal of proteome research, 11(8), 4289-4307 (2012-07-07)
Protein expression patterns in imbibed seeds of three cultivars of chickpea (Cicer arietinum L.) with different rates of germination under limiting water supply in soil (>10% water holding capacity) were compared. A large number of soluble proteins expressed earlier and
Jesper V Olsen et al.
Molecular & cellular proteomics : MCP, 3(6), 608-614 (2004-03-23)
Almost all large-scale projects in mass spectrometry-based proteomics use trypsin to convert protein mixtures into more readily analyzable peptide populations. When searching peptide fragmentation spectra against sequence databases, potentially matching peptide sequences can be required to conform to tryptic specificity
Petra A Neff et al.
Chemphyschem : a European journal of chemical physics and physical chemistry, 8(14), 2133-2137 (2007-08-28)
A silicon-on-insulator (SOI) based thin film resistor is employed for the label-free determination of enzymatic activity. We demonstrate that enzymes, which cleave biological polyelectrolyte substrates, can be detected by the sensor. As an application, we consider the serine endopeptidase trypsin
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.