Descrizione generale
Nell'uomo l'ubiquitina (Ub) è inizialmente prodotta sotto forma di un precursore di 229 amminoacidi, la poliubiquitina B (UniProt P0CG47) codificata dal gene UBB (Gene ID: 7314), o di un precursore di 685 amminoacidi, la poliubiquitina C (UniProt P0CG48) codificata dal gene UBC (Gene ID: 7316). Le scissioni post-traduzionali producono più copie identiche di molecole di ubiquitina (nota anche come proteina non istonica del gruppo ad alta mobilità HMG-20) composte da 76 a.a. ciascuna. Nel processo di ubiquitinazione, una delle modificazioni post-traduzionali (PTM) più comuni a cui sono soggette le proteine cellulari, l'Ub viene legata covalentemente, tramite l'estremità carbossilica (Gly76), alle proteine target, solitamente a livello di residui di lisina. In una data proteina target, il residuo di lisina può essere legato a una sola molecola di Ub (monoubiquitinato) o a una catena di molecole di Ub (poliubiquitinato). Nella catena di poliUb, le molecole di Ub possono essere legate tra loro o tramite uno dei sette residui di lisina (K6, K11, K27, K29, K33, K48 e K63) oppure tramite il residuo Met1 N-terminale dell'Ub (il che genera catene lineari). Lys-C è un'endopeptidasi che taglia le proteine sul lato C-terminale dei residui di lisina non modificati. Tale taglio non si verifica nel caso i residui di Lys siano legati a Ub. Il risultato di questi tagli sulla proteina saranno frammenti peptidici con una lisina all'estremità C-terminale e delle lisine interne legate al frammento residuo di ubiquitina (residuo al taglio K63-E64). Gli anticorpi diretti specificamente contro il frammento residuo C-terminale della UB (cioè da E64 a Gly76 o da E48 a Gly76 se K63 è ubiquitinato con una catena poliUb) sono compatibili con la metodologia brevettata UbiSite™ per la determinazione del sito di ubiquitinazione della lisina sviluppata dal laboratorio del Dr. Blagoy Blagoev presso la University of Southern Denmark. Tali anticorpi possono isolare i frammenti digeriti da Lys-C contenenti uno o più siti di ubiquitinazione; un'ulteriore digestione con tripsina lascia solo Gly75-Gly76 legato covalentemente alle lisine ubiquitinate sui frammenti peptidici isolati; si prosegue, infine, con l'analisi in spettrometria di massa (MS) per determinare il/i sito/i di modifica della lisina. La metodologia UbiSite™ è stata usata anche per identificare i residui di serina e treonina che subiscono ubiquitinazione catalizzata da HOIL-1. I residui di treonina 12, 14, 22 e la serina 20 dell'ubiquitina risultano formare legami esterei con l'estremità carbossilica di un'altra molecola di ubiquitina, incrementando così il numero di tipologie di legame dell'ubiquitina. La serina 175 di IRAK4, le serine 136 e 168 e la treonina 168 di IRAK2 sono state riconosciute come siti di ubiquitinazione catalizzata da HOIL-1. (Rif.: McCrory, EH., et al. (2022). Biochem. J. 479(23); 2419-2431; Akimov, V., et al. (2018). Nat. Struct. Mol. Biol. 25(7):631-640).
Specificità
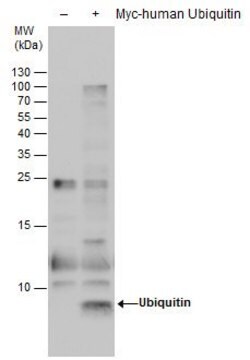
Il clone 2G7B8 rileva le proteine mono-ubiquitinate (MonoUb) e poli-ubiquitinate (polyUb), così come la molecola di ubiquitina libera (Ub), reagendo con la sequenza C-terminale rispetto alla Lys63 (tag UbiSite™). Il clone 2G7B8 può essere utilizzato per rilevare (ad es. tramite dot blot) e isolare (ad es. mediante immunoprecipitazione) i peptidi derivati da proteine ubiquitinate in seguito a digestione con l'endoproteinasi Lys-C. La Lys-C taglia l'ubiquitina e le proteine ubiquitinate dopo i residui di lisina non modificati, ma non dopo i residui di lisina ubiquitinati; genera, così, frammenti peptidici con i loro residui di lisina ubiquitinati legati al residuo C-terminale della Ub (tag UbiSite™) che non può essere riconosciuto da altri anticorpi anti-ubiquitina i cui epitopi si trovino in posizione N-terminale rispetto alla Lys63. I frammenti peptidici isolati possono poi essere analizzati in spettrometria di massa (MS) per identificare i siti di ubiquitinazione.
Prevista reattività crociata con molte specie basata su una omologia di sequenza del 100%.
Immunogeno
Epitopo: prossimo al C-terminale
Peptide lineare coniugato con KLHcorrispondente a una sequenza di 13 aminoacidi nella regione C-terminale dellaubiquitina umana.
Applicazioni
Categoria di ricerca
Signaling
L'anti-ubiquitina (pan) (detto anche anti-ubiquitina, UbiSite™, clone 2G7B8) è un anticorpo monoclonale di topo che rileva l'ubiquitina utilizzato in metodi di Western blotting e di spettrometria di massa.
Sottocategoria di ricerca
Ubiquitina & metabolismo dell′ubiquitina
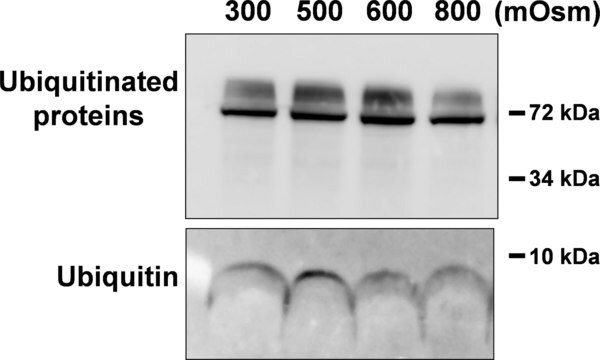
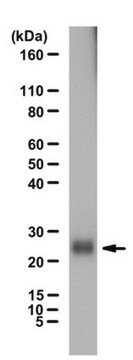
Western blotting: un lotto rappresentativo alla concentrazione di 1,0 µg/ml ha rilevato l'accumulo di proteine ubiquitinate nelle cellule epiteliali umane HEp-2 a seguito del trattamento con l'inibitore del proteasoma MG-132 (N. Cat. 474790) (Gentile concessione del Dr. Blagoy Blagoev, University of Southern Denmark).
Qualità
Testato con metodica Western blot su lisati di cellule epiteliali umane HEp-2.
Western blot: questo anticorpo alla concentrazione di 2,0 µg/ml ha permesso di rivelare le proteine ubiquitinate in 10 µg di lisato di cellule epiteliali umane HEp-2.
Descrizione del bersaglio
Variabile a seconda della dimensione della/e proteina/e o peptide/i ubiquitinato/i e dei gradi di ubiquitinazione.
Stato fisico
Formato: purificato
IgG1κ monoclonali di topo purificate in tampone contenente Tris-glicina 0,1 M (pH 7,4), NaCl 150 mM con lo 0,05% di azoturo di sodio.
Purificazione con proteina G
Stoccaggio e stabilità
Stabile per 1 anno dalla data di ricevimento a 2-8 °C.
Altre note
Concentrazione: fare riferimento alla scheda tecnica specifica del lotto.
Note legali
UbiSite is a trademark of Syddansk Universitet (University of Southern Denmark)
Esclusione di responsabilità
Salvo diversa indicazione nel nostro catalogo o in altra documentazione fornita dall′azienda insieme al prodotto, i nostri prodotti sono destinati esclusivamente a scopi di ricerca e non devono essere utilizzati per altre finalità, inclusi a titolo esemplificativo ma non esaustivo, fini commerciali non autorizzati, applicazioni diagnostiche in vitro, usi terapeutici ex vivo o in vivo o qualsiasi altro tipo di assunzione o applicazione rivolta agli esseri umani o agli animali.