T7168
Trypsine from porcine pancreas
tablet, 1 mg tablet
Se connecterpour consulter vos tarifs contractuels et ceux de votre entreprise/organisme
About This Item
Numéro CAS:
Numéro MDL:
Code UNSPSC :
12352204
Nomenclature NACRES :
NA.54
Produits recommandés
Source biologique
Porcine pancreas
Niveau de qualité
Forme
tablet
Activité spécifique
90-110% (compared to standard)
Poids mol.
23.8 kDa
Température de stockage
−20°C
Vous recherchez des produits similaires ? Visite Guide de comparaison des produits
Catégories apparentées
Description générale
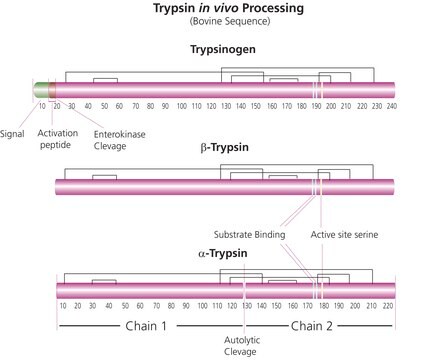
Trypsin consists of a single chain polypeptide of 223 amino acid residues, produced by the removal of the N-terminal hexapeptide from trypsinogen which is cleaved at the Lys - lle peptide bond. The sequence of amino acids is cross-linked by 6 disulfide bridges. This is the native form of trypsin, beta-trypsin. BETA-trypsin can be autolyzed, cleaving at the Lys - Ser residue, to produce alpha-trypsin. Trypsin is a member of the serine protease family.
Application
Pour la digestion trypsique des peptides, utiliser un rapport trypsine:peptide d'environ 1:100 à 1:20. La trypsine sert généralement à détacher les cellules adhérentes d'une surface de culture. La concentration qui permet de déloger les cellules de leur substrat dépend principalement du type de cellules et de l'âge de la culture. La trypsine a également été utilisée pour remettre des cellules en suspension lors de cultures cellulaires, pour digérer des protéines en recherche protéomique ou pour réaliser diverses digestions sur gel†. Parmi ses autres applications, citons l'analyse de la cristallisation par des techniques à membrane ou une étude visant à établir que le taux de repliement et le rendement des protéines peuvent être limités par la présence de pièges cinétiques.
For use in immunohistochemical procedures to enhance staining and to unmask antigens after routine fixation and processing.
Actions biochimiques/physiologiques
La trypsine clive les peptides situés du côté C-terminal des résidus lysine et arginine. Cette réaction d'hydrolyse est plus lente lorsqu'un résidu acide se situe d'un côté ou de l'autre du site de clivage, et elle s'interrompt lorsqu'un résidu proline se situe du côté carboxyle du site de clivage. L'activité de la trypsine est optimale à un pH de 7 à 9. La trypsine peut également cliver les liaisons ester et amide de dérivés d'acides aminés de synthèse. On ajoute de l'EDTA aux solutions de trypsine pour servir d'agent chélateur afin de neutraliser les ions calcium et magnésium qui masquent les liaisons peptidiques sur lesquelles la trypsine agit. L'élimination de ces ions augmente l'activité enzymatique.
Les inhibiteurs de protéases à sérine (entre autres, le DFP, la TLCK, l'APMSF, l'AEBSEF et l'aprotinine) inhibent la trypsine.
Les inhibiteurs de protéases à sérine (entre autres, le DFP, la TLCK, l'APMSF, l'AEBSEF et l'aprotinine) inhibent la trypsine.
Attention
Solutions in 1 mM HCl are stable for 1 year in aliquots and stored at -20°C. The presence of Ca2+ will also diminish the self-autolysis of trypsin and maintain its stability in solution. Trypsin will also retain most of its activity in 2.0 M urea, 2.0 M guanidine HCl, or 0.1% (w/v) SDS.
Définition de l'unité
Une unité de BAEE produit une ΔA253 de 0,001 par minute à pH 7,6 et à 25 °C lorsque le BAEE est utilisé comme substrat. 1 unité de BTEE = 320 unités d'ATEE. Volume réactionnel = 3,2 ml (trajet optique de 1 cm).
Notes préparatoires
This product is a lyophilized powder soluble in Hank′s Balanced Salt Solution at 25 mg/mL.
For applications that require EDTA, solubilizing trypsin should be done with a buffered salt solution contaiing no Ca2+ or Mg2+.
For applications that require EDTA, solubilizing trypsin should be done with a buffered salt solution contaiing no Ca2+ or Mg2+.
Inhibiteur
Réf. du produit
Description
Tarif
Substrat
Réf. du produit
Description
Tarif
Mention d'avertissement
Danger
Mentions de danger
Conseils de prudence
Classification des risques
Resp. Sens. 1
Code de la classe de stockage
11 - Combustible Solids
Classe de danger pour l'eau (WGK)
WGK 1
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Équipement de protection individuelle
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Faites votre choix parmi les versions les plus récentes :
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Les clients ont également consulté
Vipul Shrivastava et al.
Scientific reports, 11(1), 10372-10372 (2021-05-16)
Pancreatic islets adapt to insulin resistance of pregnancy by up regulating β-cell mass and increasing insulin secretion. Previously, using a transgenic mouse with global, heterozygous deletion of prolactin receptor (Prlr+/-), we found Prlr signaling is important for this adaptation. However
S Gallier et al.
Journal of dairy science, 95(7), 3579-3592 (2012-06-23)
An in vitro digestion model that simulated gastric and intestinal fasting conditions was used to monitor the physical, chemical, and structural changes of fat globules from raw bovine milk. During in vitro gastric digestion, the fat globules were stable under
Analysis of embryonic vascular morphogenesis.
T N Sato et al.
Methods in molecular biology (Clifton, N.J.), 137, 223-233 (2000-08-19)
Eryn E Dixon et al.
Journal of the American Society of Nephrology : JASN, 33(2), 279-289 (2021-12-03)
Single-cell sequencing technologies have advanced our understanding of kidney biology and disease, but the loss of spatial information in these datasets hinders our interpretation of intercellular communication networks and regional gene expression patterns. New spatial transcriptomic sequencing platforms make it
Wajiha Gohir et al.
The Journal of physiology, 597(12), 3029-3051 (2019-05-14)
Maternal obesity has been associated with shifts in intestinal microbiota, which may contribute to impaired barrier function Impaired barrier function may expose the placenta and fetus to pro-inflammatory mediators We investigated the impacts of diet-induced obesity in mice on maternal
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique