Wichtige Dokumente
T7009
Thrombin aus Humanplasma
lyophilized powder, ≥1,000 NIH units/mg protein (E1%/280, 18.3)
Synonym(e):
Faktor IIa
About This Item
Empfohlene Produkte
Form
lyophilized powder
Qualitätsniveau
Spezifische Aktivität
≥1,000 NIH units/mg protein (E1%/280, 18.3)
Mol-Gew.
37.4 kDa
Verunreinigungen
HIV and HBsAg, source material tested negative
UniProt-Hinterlegungsnummer
Anwendung(en)
diagnostic assay manufacturing
Lagertemp.
−20°C
Angaben zum Gen
human ... F2(2147)
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
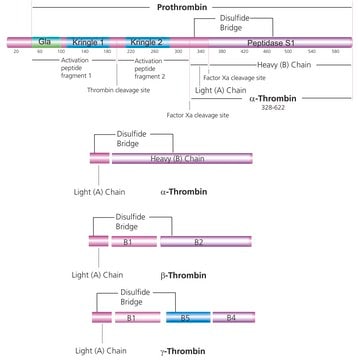
Allgemeine Beschreibung
Anwendung
- in CaCl2 gelöst und zu einer Polyethylen-Glycol-Fibrinogen/Zelllösung zur Fibrinherstellung gegeben
- zur Polymerisation von Fibrin auf Mikrowellplatten verwendet
- als eine endogene Agonist-Proteinase für proteinaseaktivierte Rezeptoren: PAR1, PAR3 und PAR4 zur Stimulation von Zellen eingesetzt
Biochem./physiol. Wirkung
Einheitendefinition
Physikalische Form
Hinweis zur Analyse
Sonstige Hinweise
Haftungsausschluss
Inhibitor
Signalwort
Danger
H-Sätze
P-Sätze
Gefahreneinstufungen
Resp. Sens. 1
Lagerklassenschlüssel
10 - Combustible liquids
WGK
WGK 3
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Artikel
Thrombin Factor IIa is an endolytic serine protease that selectively cleaves the Arg--Gly bonds of fibrinogen to form fibrin and release fibrinopeptides A and B.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.