TRYPSEQ-RO
Roche
Trypsin in Sequenzierqualität
from bovine pancreas
Synonym(e):
Trypsin
About This Item
Empfohlene Produkte
Biologische Quelle
bovine pancreas
Qualitätsniveau
Form
lyophilized (salt-free)
Spezifische Aktivität
≥80 units/mg protein
Mol-Gew.
Mr 23.5 kDa
Verpackung
pkg of 4 × 100 μg (11047841001)
pkg of 4 × 25 μg (11418475001)
Hersteller/Markenname
Roche
Optimaler pH-Wert
8.0
Lagertemp.
2-8°C
Verwandte Kategorien
Allgemeine Beschreibung
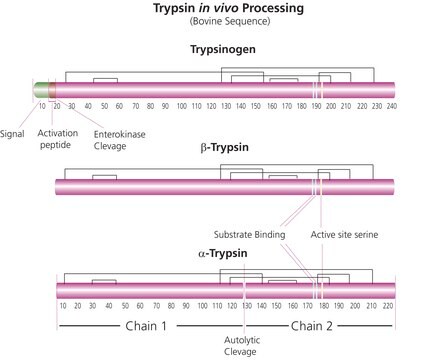
Spezifität
Spezifität (HPLC, mit Insulin Box):
Spaltung nach 1 Stunde: ≥90 %
Unspezifische Spaltungsprodukte nach 18 Stunden: ≤10 %
Anwendung
Das Enzym wird zur Aufklärung von Proteinstrukturen, für tryptisches Mapping, Fingerprinting, Sequenzanalysen und für Translokationsstudien genutzt. Trypsin in Sequenzierqualität erzeugt Glykopeptide aus aufgereinigten Glykoproteinen und ist geeignet für den Verdau von Proteinen in Polyacrylamidgelen.
Qualität
Angaben zur Herstellung
Arbeitskonzentration: 1/100 bis 1/20 des Proteins nach Gewicht (in Lösung); 1–5 μg/100 μL (für In-Gel-Verdau)
Lagerbedingungen (Arbeitslösung): Eine Lösung in 0,01 % Trifluoressigsäure (TFA), (v/v) oder 1 mM HCl kann maximal eine Woche lang verwendet werden, wenn sie bei 2 bis 8 °C gelagert wird. Durch Inkubation von Proteinen in Lösung bei neutralen bis leicht basischen pH-Werten kann eine Teilautolyse auftreten. Für diese Anwendung empfiehlt Roche modifiziertes Trypsin in Sequenzierqualität.
Rekonstituierung
Sonstige Hinweise
Signalwort
Danger
H-Sätze
Gefahreneinstufungen
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Zielorgane
Respiratory system
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 1
Flammpunkt (°F)
does not flash
Flammpunkt (°C)
does not flash
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.