Peptidsynthese
Ein Peptid besteht aus zwei oder mehr Aminosäuren, die durch eine Amidbindung miteinander verbunden sind und so eine Kette von Aminosäuren bilden, die in der Regel 2 bis 70 Aminosäuren lang ist. Peptide unterscheiden sich von Proteinen dadurch, dass sie für ihre biologische Aktivität nicht gefaltet werden müssen. Peptide kommen endogen als Peptidhormone, wie Angiotension, LHRH, Enkephalin, und als Toxine in Pflanzen und Tieren vor. Peptide sind als Leitstrukturen für die Arzneimittelforschung und als eigenständige Arzneimittel von großem Interesse. Sie finden darüber hinaus Anwendung in Impfstoffen, Biomaterialien und histologischen Sonden und werden in großer Zahl als Antigene zur Herstellung von Antikörpern verwendet.
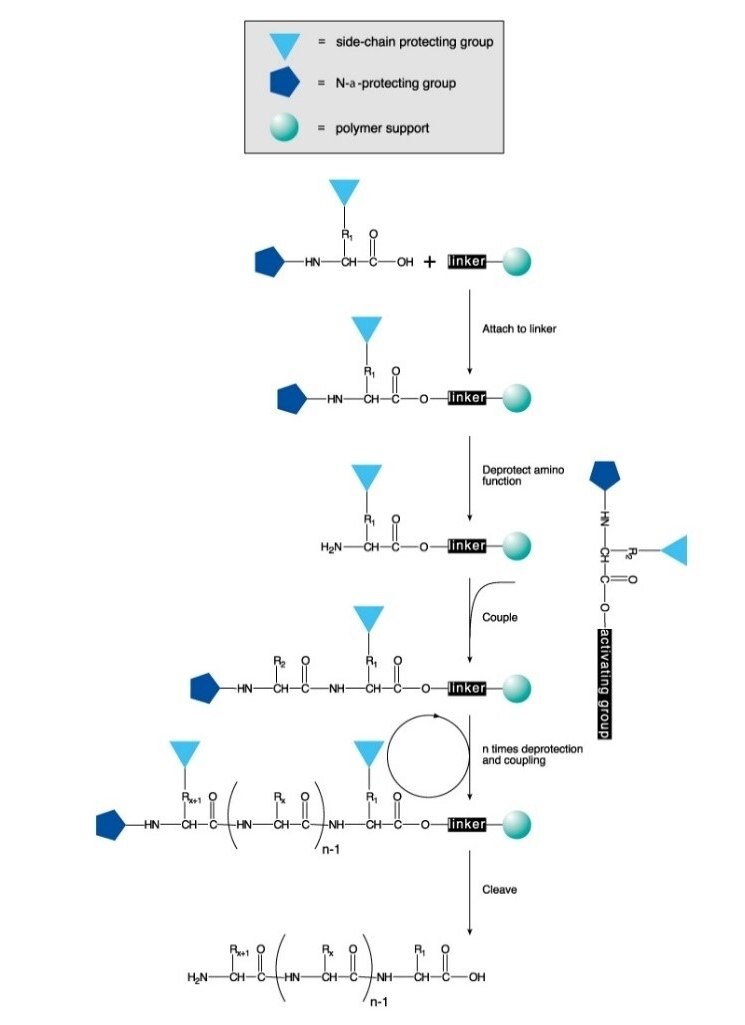
Peptide werden entweder in Lösung oder an einer festen Phase chemisch synthetisiert. Das Verfahren beinhaltet die gezielte und selektive Bildung einer Amidbindung zwischen einer N-geschützten Aminosäure und einer Aminosäure mit einer freien Aminogruppe und einer geschützten Carbonsäure. Bei der Festphasensynthese wird die Carboxylschutzgruppe an einen Polymerträger gebunden. Nach der Bindungsbildung wird die Aminoschutzgruppe des Dipeptids entfernt, und die nächste N-geschützte Aminosäure gekoppelt.
Zugehörige technische Artikel
- Fmoc resin cleavage and deprotection follows the difficult task of detaching the peptide from the resin support and removing all the side-chain protecting groups of the amino acid residues to yield the desired peptide.
- Novabiochem® offers a large number of coupling reagents for in situ activation. In situ activating reagents are easy to use, fast reacting – even with sterically hindered amino acids, and their use is generally free of side reactions.
- Review methods and resins for attaching amino acids and peptides, including Merrifield, trityl-based, and hydroxymethyl-functionalized resins. Resin-immobilized peptides can be used for various downstream applications.
- COMU is a non-explosive coupling agent suitable for solution phase & solid phase peptide synthesis. Its activity meets or exceeds that of HATU and its water-soluble by-product are easily removed.
- In principle, the seemingly simple formation of a peptide bond can be accomplished using all the procedures available in organic chemistry for the synthesis of carboxylic acid amides. However, due to the presence of various functional groups in natural and unnatural amino acids and particularly the requirement for full retention of chiral integrity, the coupling of amino acids and peptides under mild conditions can be challenging. A plethora of coupling reagents has been developed superseding each other in efficiency and suitability for specific applications (e.g., solid-phase peptide synthesis or fragment condensation).
- Alle anzeigen (22)
Zugehörige Protokolle
- A guide to create solvent systems used for the thin-layer chromatography assay of Novabiochem products.
- Overcome challenges in synthesis and disulfide bond formation with protocols for Fmoc solid-phase peptide synthesis of peptides with cysteine and methionine.
- Amide Coupling in a Box
- Information on the Amide bond and the Catalytic Amide Bond Formation Protocol. Amidation of amines and alcohols. The amide bond, an important linkage in organic chemistry, is a key functional group in peptides, polymers, and many natural products and pharmaceuticals.
- We provide an overview of our available reagents, together with recommendations and details of their use for synthesis of peptides containing post-translationally modified amino acids.
- Alle anzeigen (10)

Abbildung 2Seitenkettenschutzgruppen für die Boc-Festphasenpeptidsynthese (SPPS)
Die Festphasen-Peptidsynthese (SPPS) ist aufgrund ihrer Effizienz, Einfachheit, Geschwindigkeit und leichten Parallelisierbarkeit die am häufigsten verwendete Methode der Peptidsynthese. Bei der SPPS werden nacheinander Amino- und seitenkettengeschützte Aminosäurereste einer Aminosäure oder einem Peptid hinzugefügt, die/das an einen unlöslichen Polymerträger angelagert ist (Abbildung 1).
Für den N-α-Schutz wird entweder eine säurelabile Boc-Gruppe (Boc SPPS) oder eine basenlabile Fmoc-Gruppe (Fmoc SPPS) verwendet. Nach Entfernung dieser Schutzgruppe wird die nächste geschützte Aminosäure entweder mit einem Kupplungsreagenz oder einem zuvor aktivierten geschützten Aminosäurederivat hinzugefügt. Die C-terminale Aminosäure ist über einen Linker am Harz verankert, dessen Art die Bedingungen bestimmt, die erforderlich sind, um das Peptid nach der Kettenverlängerung vom Träger zu lösen. Die Schutzgruppen der Seitenketten werden häufig so gewählt, dass sie gleichzeitig mit der Ablösung des Peptids vom Harz abgespalten werden (Abbildung 2 und 3).

Abbildung 3.Seitenkettenschutzgruppen für die Fmoc-Festphasenpeptidsynthese (SPPS)
Die meisten Peptide werden nach der Fmoc-Methode hergestellt, da die abschließende Spaltung und Entschützung durch Behandlung mit Trifluoressigsäure erfolgt, im Gegensatz zur Boc-Methode, die den Einsatz von hochtoxischem, korrosivem, flüssigem, wasserfreiem HF in Spezialgeräten erfordert.
Peptide mit 50 Aminosäuren können routinemäßig hergestellt werden, obwohl die Synthese von Proteinen mit mehr als 100 Aminosäuren allgemein bekannt ist. Längere Proteine können durch native chemische Ligation vollständig entschützter Peptide in Lösung hergestellt werden. Mit dieser Methode ist es möglich, natürliche Peptide zu synthetisieren, die in Bakterien schwer zu exprimieren sind, unnatürliche oder D-Aminosäuren einzubauen und zyklische, verzweigte, markierte und posttranslational modifizierte Peptide zu erzeugen.
Die Flüssigphasenpeptidsynthese, bei der in der Regel ein Boc- oder Z-Aminoschutz verwendet wird, wurde durch die Festphasenpeptidsynthese ersetzt. Eine Ausnahme bilden bestehende Verfahren für die Peptidsynthese im großen Maßstab für industrielle Zwecke.
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?