MABN10
Anti-Beta (β)-Amyloid antibody
mouse monoclonal, WO2
Synonyme(s) :
Alzheimer disease, Alzheimer disease amyloid protein, Cerebral vascular amyloid peptide, Protease nexin-II, amyloid beta (A4) precursor protein, amyloid beta A4 protein, amyloid beta precursor protein, beta-amyloid peptide, human mRNA for amyloid A4 prec
About This Item
Produits recommandés
Nom du produit
Anticorps anti-amyloïde β, clone W0-2, clone WO2, from mouse
Source biologique
mouse
Niveau de qualité
Forme d'anticorps
purified immunoglobulin
Clone
WO2, monoclonal
Espèces réactives
mouse, human
Technique(s)
ELISA: suitable
immunohistochemistry: suitable (paraffin)
western blot: suitable
Isotype
IgG2aκ
Numéro d'accès NCBI
Numéro d'accès UniProt
Conditions d'expédition
wet ice
Modification post-traductionnelle de la cible
unmodified
Informations sur le gène
human ... APP(351)
Description générale
Spécificité
Immunogène
Application
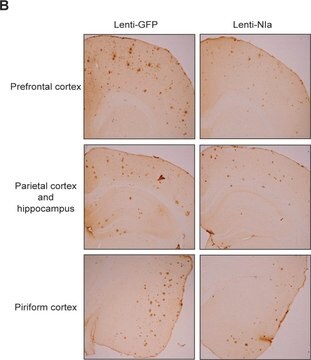
Neurosciences
Maladies neurodégénératives
Qualité
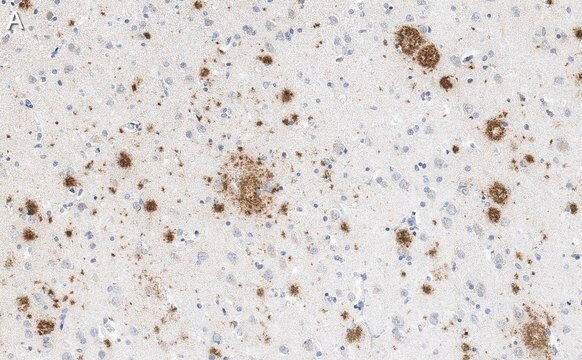
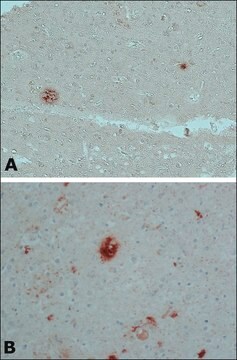
Analyse par western blotting : Une concentration de 0,5 µg/mL de cet anticorps a permis de détecter l'amyloïde β dans 10 µg de lysat de tissu cérébral humain atteint de la maladie d'Alzheimer.
Description de la cible
Liaison
Forme physique
Stockage et stabilité
Remarque sur l'analyse
Lysat de tissu cérébral humain atteint de la maladie d'Alzheimer.
Autres remarques
Clause de non-responsabilité
En option
Code de la classe de stockage
12 - Non Combustible Liquids
Classe de danger pour l'eau (WGK)
WGK 1
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Certificats d'analyse (COA)
Recherchez un Certificats d'analyse (COA) en saisissant le numéro de lot du produit. Les numéros de lot figurent sur l'étiquette du produit après les mots "Lot" ou "Batch".
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Les clients ont également consulté
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique