G3664
Glutatión reductasa from baker′s yeast (S. cerevisiae)
ammonium sulfate suspension, 100-300 units/mg protein (biuret)
Sinónimos:
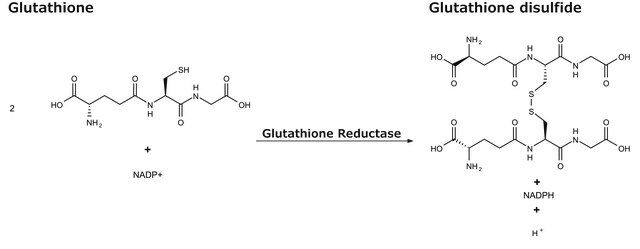
GR, NAD(P)H:oxidado-glutatión oxidorreductasa
About This Item
Productos recomendados
form
ammonium sulfate suspension
Quality Level
specific activity
100-300 units/mg protein (biuret)
mol wt
118 kDa
UniProt accession no.
foreign activity
G-6-PDH, 6-PGDH, and NADPH oxidase ≤0.01%
lipoamide dehydrogenase ≤0.1%
storage temp.
2-8°C
Gene Information
bakers yeast ... GLR1(856014)
¿Está buscando productos similares? Visita Guía de comparación de productos
General description
Application
- en el análisis del glutatión para determinar la concentración de glutatión.
- como patrón en la generación de la curva de calibración.
- como antígeno para medir la actividad plasmática de la GR.
- para cuantificar el contenido de glutatión en el tejido miocárdico utilizando un ensayo de reciclado enzimático basado en la glutatión reductasa-5,5′-ditiobis (ácido 2-nitrobenzoico)
- para la cuantificación de glutatión reducido (GSH) en los ovocitos, utilizando un ensayo de microglutatión ligeramente modificado, obtenido de doradas prepuberales
- para la preparación de GSSG (disulfuro de glutatión) total + medición de GSH, donde todos los GSSG disponibles se redujeron a GSH, en cristalino de rata
- para la cuantificación del glutatión reducido intracelular (GSH) en los ovocitos obtenidos de ratas
Biochem/physiol Actions
Unit Definition
Physical form
Preparation Note
inhibitor
related product
signalword
Danger
hcodes
pcodes
Hazard Classifications
Resp. Sens. 1
Storage Class
12 - Non Combustible Liquids
wgk_germany
WGK 2
flash_point_f
Not applicable
flash_point_c
Not applicable
Elija entre una de las versiones más recientes:
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Los clientes también vieron
Artículos
Instructions for working with enzymes supplied as ammonium sulfate suspensions
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico