推薦產品
生物源
synthetic (organic)
品質等級
化驗
≥98% (HPLC)
形狀
powder
溶解度
water: 20 mg/mL, clear, colorless to faintly yellow
儲存溫度
2-8°C
SMILES 字串
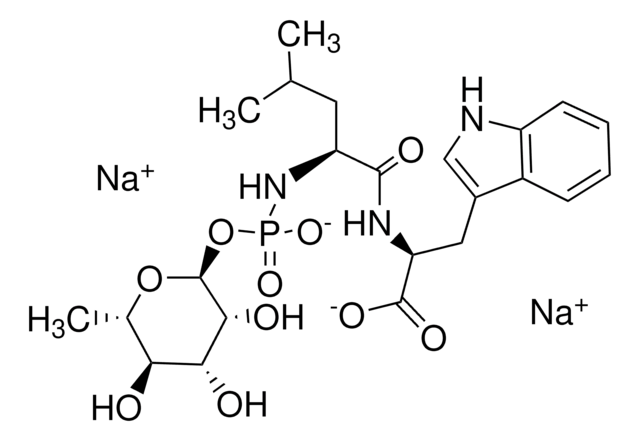
CC(C)C[C@H](NC(=O)[C@@H]1O[C@H]1C(O)=O)C(=O)NCCCCNC(N)=N
InChI
1S/C15H27N5O5/c1-8(2)7-9(20-13(22)10-11(25-10)14(23)24)12(21)18-5-3-4-6-19-15(16)17/h8-11H,3-7H2,1-2H3,(H,18,21)(H,20,22)(H,23,24)(H4,16,17,19)/t9-,10+,11+/m0/s1
InChI 密鑰
LTLYEAJONXGNFG-HBNTYKKESA-N
尋找類似的產品? 前往 產品比較指南
一般說明
E-64 是从霉菌 日本曲霉 TPR-64中分离出来的半胱氨酸蛋白酶抑制剂。 E-64 又称N-[N-(L-3-反式-羧氧吡喃-2-羰基)-L-亮氨酰]-胍丁胺。E-64可以有效抑制各种半胱氨酸蛋白酶,特别是:
- 组织蛋白酶K
- 组织蛋白酶L
- 组织蛋白酶S
- 钙蛋白酶
- 组织蛋白酶B
- 组织蛋白酶H
- 木瓜蛋白酶
應用
E-64是亲和纯化半胱氨酸蛋白酶的有效配体。当与硫醇化亲和基质偶联时,结合将成为可逆的,但保留了特异性。
生化/生理作用
E-64是一种不可逆的、强效的、高选择性半胱氨酸蛋白酶抑制剂。E-64不与非蛋白酶的功能性硫醇基团反应,如 L-乳酸脱氢酶或肌酸激酶。与亮抑酶肽和抗蛋白酶肽等其他半胱氨酸蛋白酶抑制剂不同,E-64不会抑制丝氨酸蛋白酶(胰蛋白酶除外)。E-64的反式环氧琥珀酰基(活性部分)不可逆地与许多半胱氨酸蛋白酶的活性巯基结合,如木瓜蛋白酶、猕猴桃酶和组织蛋白酶B、H和L,从而形成硫醚键。 E-64是一种非常有用的半胱氨酸蛋白酶抑制剂,具有特异性抑制作用,在细胞和组织中具有渗透性,毒性低,可用于 体内 研究。
準備報告
E-64可溶于水。可配制成20 mg/ml的水溶液(可能需要加热)。 建议储备溶液是1 mM水溶液。用作蛋白酶抑制剂的有效浓度为1至10 μM。 水溶液储备溶液可在-20°C稳定保存数月。稀释液可在中性pH体系中稳定保存数天。 E-64在pH 2-10体系中稳定,但在氨水或HCl体系中不稳定。 E-64也溶于DMSO,可使用无水DMSO制备10 mM溶液并储存在-20℃。使用培养基进行后续稀释。将E-64溶解在0.9%氯化钠溶液中或溶解在最少量的饱和碳酸氢钠溶液中并用0.9%氯化钠稀释(用乙酸调节pH至7.0),可制备注射液。
儲存類別代碼
11 - Combustible Solids
水污染物質分類(WGK)
WGK 3
閃點(°F)
Not applicable
閃點(°C)
Not applicable
個人防護裝備
Eyeshields, Gloves, type N95 (US)
分析證明 (COA)
輸入產品批次/批號來搜索 分析證明 (COA)。在產品’s標籤上找到批次和批號,寫有 ‘Lot’或‘Batch’.。
客戶也查看了
F D Nascimento et al.
Journal of dental research, 90(4), 506-511 (2011-01-21)
Matrix metalloproteinases (MMPs) are important in dentinal caries, and analysis of recent data demonstrates the presence of other collagen-degrading enzymes, cysteine cathepsins, in human dentin. This study aimed to examine the presence, source, and activity of cysteine cathepsins in human
P M C Scaffa et al.
Journal of dental research, 91(4), 420-425 (2012-01-24)
The co-expression of MMPs and cysteine cathepsins in the human dentin-pulp complex indicates that both classes of enzymes can contribute to the endogenous proteolytic activity of dentin. Chlorhexidine (CHX) is an efficient inhibitor of MMP activity. This study investigated whether
Marie-Thérèse Bawolak et al.
Pharmacological research, 65(2), 247-253 (2011-11-24)
Maximakinin, a 19-residue peptide from the amphibian Bombina maxima, incorporates the full sequence of bradykinin (BK) at its C-terminus with a hydrophilic 10-residue N-terminal extension. As a putative venom component, it may stimulate BK B(2) receptors (B(2)Rs) in a distinct
Yohei Osako et al.
The FEBS journal, 277(21), 4412-4426 (2010-09-21)
Calpain 7, a mammalian ortholog of yeast Cpl1/Rim13 and fungal PalB, is an atypical calpain that lacks a penta-EF-hand domain. Previously, we reported that a region containing a tandem repeat of microtubule-interacting and transport (MIT) domains in calpain 7 interacts
Marina S Defferrari et al.
Insect biochemistry and molecular biology, 41(6), 388-399 (2011-03-08)
Jackbean (Canavalia ensiformis) ureases are entomotoxic upon the release of internal peptides by insect's digestive enzymes. Here we studied the digestive peptidases of Oncopeltus fasciatus (milkweed bug) and its susceptibility to jackbean urease (JBU). O. fasciatus nymphs fed urease showed
文章
Papain is a cysteine protease of the peptidase C1 family. Papain consists of a single polypeptide chain with three disulfide bridges and a sulfhydryl group necessary for activity of the enzyme.
我們的科學家團隊在所有研究領域都有豐富的經驗,包括生命科學、材料科學、化學合成、色譜、分析等.
聯絡技術服務



![N-[(2S,3R)-3-氨基-2-羟基-4-苯基丁酰基]-L-亮氨酸 97%](/deepweb/assets/sigmaaldrich/product/structures/938/715/04f08fd1-8b5f-425c-a0bb-bbf530256760/640/04f08fd1-8b5f-425c-a0bb-bbf530256760.png)