推荐产品
生物源
Streptomyces kanamyceticus
品質等級
重組細胞
expressed in E. coli
描述
N-Terminal histidine-tagged
形狀
lyophilized powder
分子量
Mw 32599.98 by amino acid sequence
&epsilon ;(消光係數)
26,600 M-1cm-1 at 280 nm (His-tag-cleaved dissolved in 20 mM Tris pH 7.4, 0.1M NaCl, 0.5mM EDTA and 0.01%NaN3)(lit.)
29,400 M-1cm-1 at 280 nm (uncleaved His-tagged dissolved in 20 mM Tris pH 7.4, 0.1M NaCl, 0.5mM EDTA and 0.01%NaN3)(lit.)
儲存溫度
−20°C
正在寻找类似产品? 访问 产品对比指南
一般說明
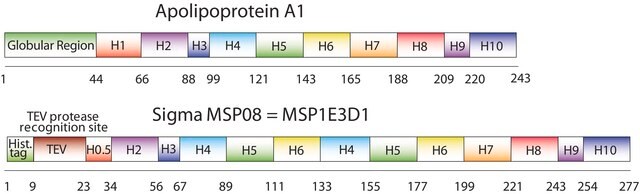
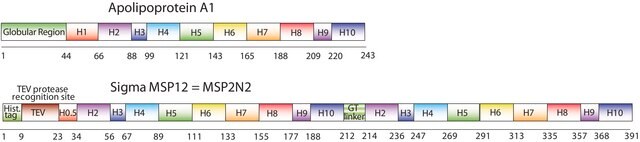
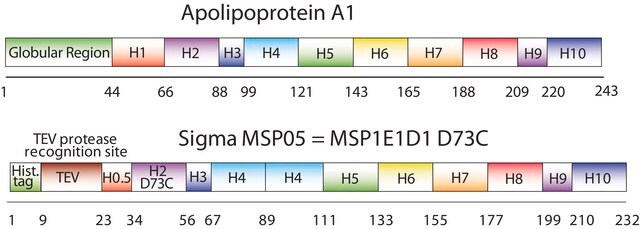
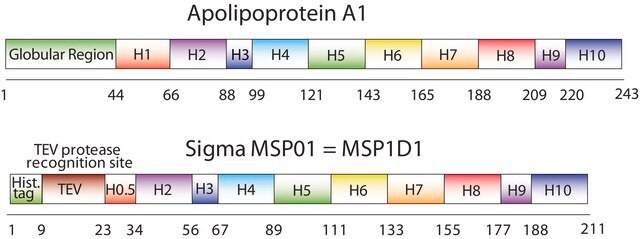
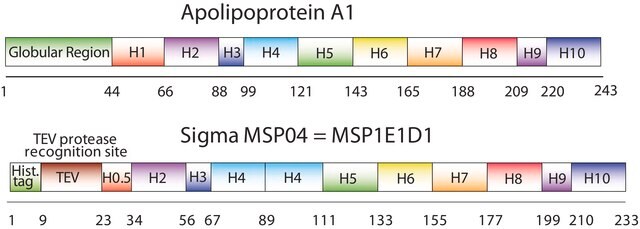
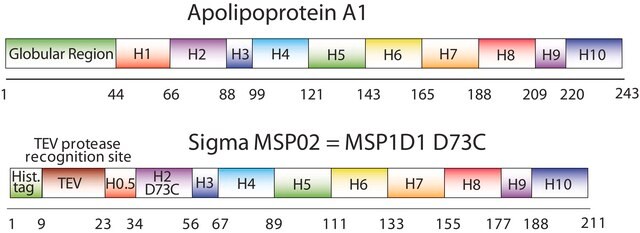
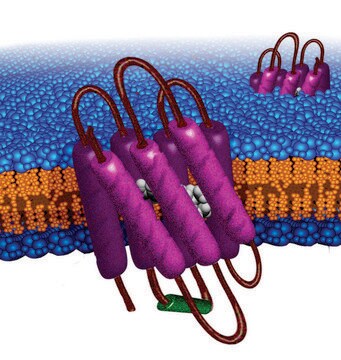
纳米盘的概念来源于高密度脂蛋白 (HDL) 颗粒及其主要蛋白质成分——载脂蛋白。纳米盘是磷脂双层膜支架蛋白 (MSP) 的非共价结构,MSP 是一种基因工程蛋白,模仿载脂蛋白 A-1 (ApoA-1) 的功能。可溶性纳米盘随着磷脂形成双层组合,双层被两个两亲性 MSP 分子包围,覆盖在双层的疏水烷基链上。MSP 的长度控制着纳米盘结构的大小。MSP1E3D1 产生 ~12.9 nm 的纳米盘。纳米盘的厚度取决于所含磷脂的类型(通常为 4.6−5.6 nm)。
應用
纳米盘可溶性脂质双层系统已被证明是一种广泛适用的手段,用于使膜蛋白溶在水溶液中的类似天然的双层膜环境中,维持其单分散和活性。纳米盘的关键组分是包绕着两亲性螺旋蛋白质带(膜支架蛋白)。
纳米盘系统已被用于包裹多种蛋白质,包括 GPCR、P450、细菌视紫红质、凝血因子、霍乱毒素、TAR 受体和芳香酶。
有关使用本 MSP 和其他 MSP′ 制备纳米盘的指南,请访问我们的膜支架蛋白和纳米盘形成实验方案页。
生化/生理作用
生成直径约 12.9nm 的纳米盘
物理性質
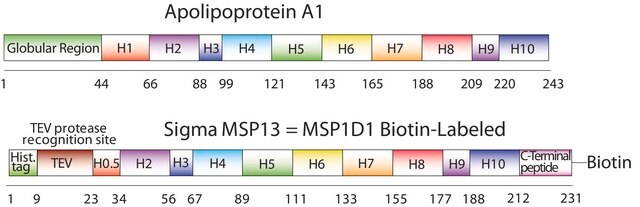
序列:GHHHHHHHDYDIPTTENLYFQGSTFSKLREQLGPVTQEFWDNLEKETEGLRQEMSKDLEEVKAKVQPYLDDFQKKWQEEMELYRQKVEPLRAELQEGARQKLHELQEKLSPLGEEMRDRARAHVDALRTHLAPYLDDFQKKWQEEMELYRQKVEPLRAELQEGARQKLHELQEKLSPLGEEMRDRARAHVDALRTHLAPYSDELRQRLAARLEALKENGGARLAEYHAKATEHLSTLSEKAKPALEDLRQGLLPVLESFKVSFLSALEEYTKKLNTQ
外觀
以组氨酸标记的蛋白质冻干品形式提供,其中 TEV 蛋白酶切割位点用 Tris-HCl、EDTA 和 NaCl 稳定化。
法律資訊
纳米盘技术,以及它的许多用途,均由伊利诺伊大学所有的下列专利所保护。
- 7,691,414 膜支架蛋白
- 7,662,410 膜支架蛋白和嵌入膜蛋白
- 7,622,437组织因子组合物和方法
- 7,592,008 膜支架蛋白
- 7,575,763 膜支架蛋白和栓系膜蛋白
- 7,083,958 膜支架蛋白
- 7,048,949 膜支架蛋白
相關產品
产品编号
说明
价格
訊號詞
Warning
危險聲明
危險分類
Eye Irrit. 2 - Skin Irrit. 2 - STOT SE 3
標靶器官
Respiratory system
儲存類別代碼
11 - Combustible Solids
水污染物質分類(WGK)
WGK 3
閃點(°F)
Not applicable
閃點(°C)
Not applicable
其他客户在看
Koichiro E Kishi et al.
Cell, 185(4), 672-689 (2022-02-04)
ChRmine, a recently discovered pump-like cation-conducting channelrhodopsin, exhibits puzzling properties (large photocurrents, red-shifted spectrum, and extreme light sensitivity) that have created new opportunities in optogenetics. ChRmine and its homologs function as ion channels but, by primary sequence, more closely resemble
Mikihiro Shibata et al.
Scientific reports, 8(1), 8262-8262 (2018-05-31)
Oligomeric assembly is a common feature of membrane proteins and often relevant to their physiological functions. Determining the stoichiometry and the oligomeric state of membrane proteins in a lipid bilayer is generally challenging because of their large size, complexity, and
Keiichi Inoue et al.
Nature communications, 7, 13415-13415 (2016-11-18)
Light-driven outward H
Wataru Shihoya et al.
Nature, 574(7776), 132-136 (2019-09-27)
Heliorhodopsins (HeRs) are a family of rhodopsins that was recently discovered using functional metagenomics1. They are widely present in bacteria, archaea, algae and algal viruses2,3. Although HeRs have seven predicted transmembrane helices and an all-trans retinal chromophore as in the
Tomomi Shionoya et al.
The journal of physical chemistry. B, 122(27), 6945-6953 (2018-06-13)
Thermophilic rhodopsin (TR) is a light-driven proton pump from the extreme thermophile Thermus thermophilus JL-18. Previous studies on TR solubilized with detergent showed that the protein exhibits high thermal stability and forms a trimer at room temperature but irreversibly dissociates
商品
Read our article about how the Nanodisc system allows for structural studies of membrane proteins.
我们的科学家团队拥有各种研究领域经验,包括生命科学、材料科学、化学合成、色谱、分析及许多其他领域.
联系技术服务部门