Przegląd szlaku odpowiedzi na uszkodzenia DNA: Sygnalizacja i cele
- Co to jest szlak odpowiedzi na uszkodzenia DNA?
- Kluczowe cele punktów kontrolnych uszkodzeń DNA
- ATM i ATR
- p53.
- Referencje
Targetowanie szlaku odpowiedzi na uszkodzenia DNA jest ważne w badaniach nad rakiem, sygnalizacją komórkową, chorobami neurologicznymi i nie tylko. Zobacz, jak kluczowe cele uszkodzeń DNA, takie jak MDM2, p53, ATM, ATR, p21, CDK2/Cyklina E, GADD45 i inne współdziałają w celu regulacji punktów kontrolnych uszkodzeń DNA poniżej.
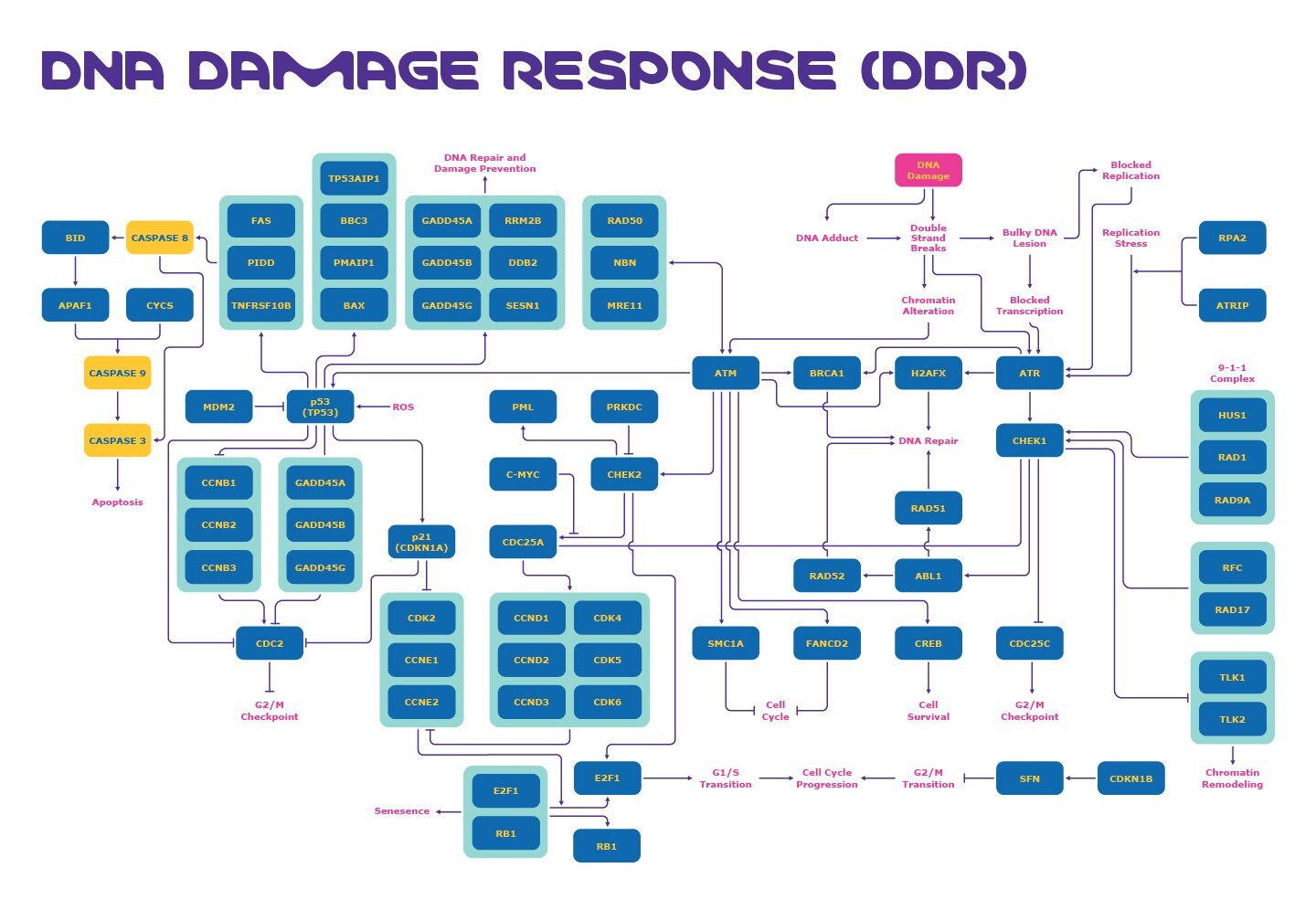
Co to jest szlak odpowiedzi na uszkodzenie DNA?
Ścieżka odpowiedzi na uszkodzenie DNA (DDR) jest inicjowana przez komórki w celu naprawy DNA po wykryciu uszkodzenia DNA. Istnieją różne rodzaje uszkodzeń DNA, w tym endogenne uszkodzenia DNA i egzogenne uszkodzenia DNA. Przykłady każdego z nich obejmują:1
- Endogenne: błędy replikacji, deaminacja zasad, uszkodzenia oksydacyjne przez reaktywne formy tlenu itp.
- Ekstogenne: promieniowanie jonizujące, promieniowanie ultrafioletowe, chemikalia/toksyny, stres środowiskowy itp.
Skutki uszkodzeń DNA obejmują mutacje, apoptozę i inne. Uszkodzenia te mogą prowadzić do rozregulowania funkcji komórek, a ostatecznie do raka, chorób neurologicznych i przedwczesnego starzenia się.2
Kluczowe cele punktów kontrolnych uszkodzeń DNA
Istnieją punkty kontrolne cyklu komórkowego, które mogą być aktywowane w odpowiedzi na uszkodzenia DNA. Te punkty kontrolne uszkodzeń DNA obejmują:
- Punkt kontrolny G1 (między fazami G1 i S)
- Punkt kontrolny Intra-S (w fazie S)
- Punkt kontrolny G2 (między fazami G2 i M)
Kluczowe białka związane z tymi punktami kontrolnymi w szlaku DDR mogą być wykorzystane jako cele do głębszego zrozumienia tego procesu i znalezienia potencjalnych środków terapeutycznych. Te kluczowe cele punktów kontrolnych uszkodzeń DNA obejmują:
- MDM2 (Mouse double minute 2)
- p53 (Tumor protein p53)
- ATM (Ataxia-telangiectasia mutated)
- ATR (Ataxia-telangiectasia and Rad3-related)
- p21 (inhibitor kinazy zależnej od cyklin)
- CDK2/Cyklina E (kinaza zależna od cyklin 2)
Cele DDR odgrywają kluczową rolę w mechanizmach zaangażowanych w punkty kontrolne G1/S, S i G2/M. 3 W szczególności, role ATM, ATR i p53 są popularne w badaniach nad odpowiedzią na uszkodzenia DNA.
ATM i ATR
ATM jest ważna w różnych aspektach odpowiedzi na uszkodzenia DNA (Rysunek 1). Kinaza ATM jest aktywowana przez podwójne pęknięcia nici DNA, które prowadzą do zmian w chromatynie i uruchamiają punkt kontrolny G1 poprzez aktywację kinazy punktu kontrolnego 2 (CHEK2). CHEK2 następnie hamuje CDC25A, co zapobiega hamowaniu CDK2/Cykliny E i ostatecznie zapobiega przejściu komórki do fazy S. 3
Kinaza ATR jest aktywowana przez pęknięcia podwójnej nici DNA i zablokowaną transkrypcję oraz aktywuje punkt kontrolny wewnątrz fazy S. ATR aktywuje kinazę punktu kontrolnego 1 (CHEK1), która indukuje degradację CDC25A i powstrzymuje komórkę przed przejściem przez fazę S. 3 Kinaza ATR i CHEK1 aktywują również punkt kontrolny G2. CHEK1 hamuje CDC25C, co zapobiega przejściu komórki do fazy M. 3
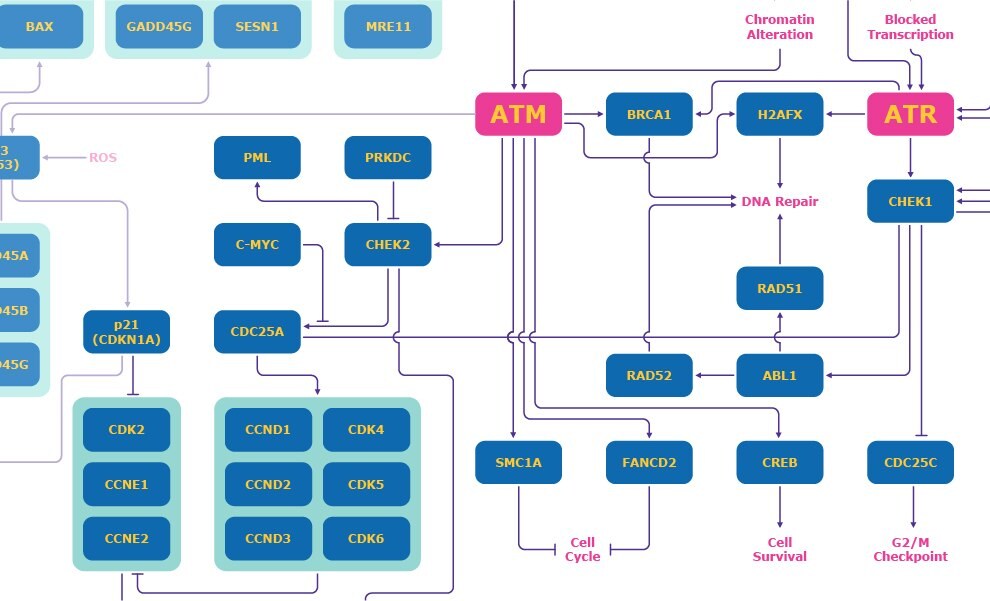
Rysunek 1. Szlak odpowiedzi na uszkodzenia DNA skupiający się na mechanizmach ATM i ATR.
p53
Punkt kontrolny G1 jest również zależny od p53. Białko supresorowe p53 jest znane jako "strażnik genomu" i zwykle znajduje się na niskim poziomie z powodu interakcji w pętli ujemnego sprzężenia zwrotnego z MDM2, ligazą ubikwityny. 4 W odpowiedzi na uszkodzenie DNA, ATM może indukować fosforylację p53, co zmniejsza efekt MDM2 i aktywuje p53. Reaktywne formy tlenu (ROS) również aktywują p53. Indukuje to p21 (Rysunek 2), który hamuje CDK2/Cyklinę E i zapobiega przejściu do fazy S.5
Aktywowane p53 również reguluje w górę kompleks GADD45, który ma produkty wpływające na zatrzymanie cyklu komórkowego i apoptozę oraz zapobiega progresji do fazy S. Może również inicjować naprawę DNA. Może również inicjować naprawę DNA. 6 Kompleks GADD45 może również hamować CDC2, co powoduje zatrzymanie fazy G2/M, zapobiegając wejściu w mitozę w punkcie kontrolnym G2. 4
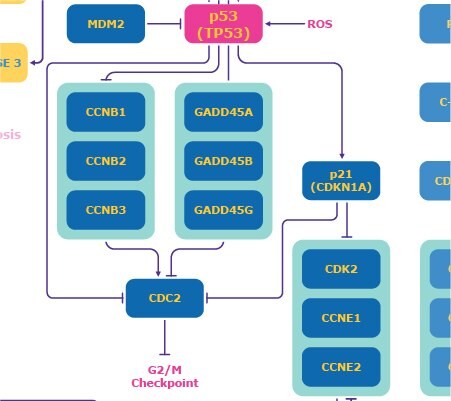
Rysunek 2Szlak odpowiedzi na uszkodzenia DNA skupiający się na p53.
Ścieżki i informacje przedstawione na tej stronie służą wyłącznie celom edukacyjnym. Przed przeprowadzeniem badań należy zawsze zapoznać się z literaturą.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?