Filtry membranowe do analizy mikroplastików
W celu ułatwienia nawigacji kliknij poniższe linki:
Czym są mikrodrobiny plastiku?
Mikrodrobiny plastiku to małe cząsteczki plastiku o wielkości od 1 do 5 milimetrów, które stały się istotnym problemem środowiskowym ze względu na ich potencjalny wpływ na ekosystemy morskie i słodkowodne oraz zdrowie ludzi. Odkrycia związane z mikrodrobinami plastiku w środowisku mnożą się w ostatnich latach w zdumiewającym tempie. Te różnorodne cząstki dostały się do środowiska w oszałamiającym tempie z różnych źródeł, takich jak butelki z wodą, materiały opakowaniowe, odzież, odpady przemysłowe, opony, produkty do higieny osobistej i środki czyszczące.
Mikroplastiki są klasyfikowane jako "pierwotne" lub "wtórne". Pierwotne mikroplastiki to te, które są celowo wytwarzane w swoim rozmiarze i kształcie do szerokiej gamy zastosowań, takich jak mikrogranulki stosowane w produktach do higieny osobistej i granulki produkcyjne do formowania wtryskowego. Wtórne mikrodrobiny plastiku powstają w wyniku degradacji większych plastikowych przedmiotów w środowisku, takich jak plastikowe torby, butelki na wodę i materiały opakowaniowe.1 Ścieranie mechaniczne, promieniowanie ultrafioletowe (UV), degradacja (mikro)biologiczna i ogólne zużycie tworzyw sztucznych prowadzą do powstawania mikrodrobin plastiku, najczęściej polipropylenu (PP), polichlorku winylu (PVC), poliuretanu (PUR), politereftalanu etylenu (PET) i polistyrenu (PS). Cząsteczki te są wszechobecnymi zanieczyszczeniami środowiska występującymi w oceanach, rzekach, jeziorach, a nawet w powietrzu, którym oddychamy.
Regulacje dotyczące mikroplastiku
Regulacje dotyczące mikroplastiku różnią się znacznie w różnych częściach świata, przy czym niektóre kraje i regiony przyjmują bardziej proaktywne podejście niż inne. W wielu krajach rozwijających się, w których systemy gospodarki odpadami mogą być nieodpowiednie, istnieje niewiele lub nie ma żadnych przepisów dotyczących uwalniania mikrodrobin plastiku do środowiska. W innych krajach opracowano wewnętrzne metody analityczne ze względu na natychmiastową potrzebę testowania.
Europa
Unia Europejska (UE) przyjęła wiodącą rolę w regulowaniu mikrodrobin plastiku. W styczniu 2019 r. UE przyjęła zakaz stosowania mikrodrobin plastiku w kilku produktach, w tym mikrogranulek w produktach higieny osobistej. Zakaz zabrania produkcji i sprzedaży produktów z celowo dodanymi mikrodrobinami plastiku, z pewnymi wyjątkami.2 UE ustanowiła również limity ilości mikrodrobin plastiku, które mogą być uwalniane do środowiska, wymagając od państw członkowskich monitorowania i raportowania poziomów mikrodrobin plastiku w środowisku.
Ameryka Północna
Obecnie w Stanach Zjednoczonych nie ma konkretnych przepisów federalnych dotyczących mikrodrobin plastiku. Istnieją jednak przepisy i regulacje, które pośrednio odnoszą się do mikrodrobin plastiku, a niektóre stany podjęły własne działania. Na przykład w 2015 r. podpisano ustawę Microbead-Free Waters Act, która zakazała stosowania plastikowych mikrogranulek w spłukiwanych produktach kosmetycznych.3 Ustawa o czystej wodzie reguluje odprowadzanie zanieczyszczeń, w tym mikrodrobin plastiku, do wód narodowych.4 Kilka stanów, w tym Kalifornia i Nowy Jork, wprowadziło przepisy zakazujące lub ograniczające stosowanie mikrodrobin plastiku w niektórych produktach, takich jak produkty higieny osobistej, jednorazowe torby plastikowe i środki czyszczące.
W Kanadzie opracowano i opracowuje się polityki ukierunkowane na określone podzbiory mikrodrobin plastiku. Obejmują one zakaz sprzedaży i produkcji mikrogranulek w kosmetykach (2019 r.) oraz sześciu jednorazowych artykułów z tworzyw sztucznych, które są powszechnym źródłem wtórnych mikrodrobin plastiku (2022 r.).5
Azja
Kilka krajów w Azji podjęło kroki w celu uregulowania kwestii mikrodrobin plastiku. Na przykład w Chinach wprowadzono zakaz produkcji i sprzedaży mikrogranulek w produktach higieny osobistej.6 Japonia wdrożyła również dobrowolny program, w ramach którego firmy mogą zobowiązać się do ograniczenia stosowania mikrogranulek w swoich produktach.7 W Korei Południowej ustalono limit wielkości mikrodrobin plastiku, które mogą być stosowane w produktach higieny osobistej.8 Zarówno Australia, jak i Nowa Zelandia zakazały stosowania mikrodrobin plastiku w produktach higieny osobistej. Ponadto australijski rząd uruchomił Narodowy Plan Tworzyw Sztucznych, który obejmuje środki mające na celu rozwiązanie problemu mikrodrobin plastiku w środowisku.9
Standardy
Organizacje normalizacyjne ASTM i ISO skoncentrowały ostatnio wysiłki na metodach mikrodrobin plastiku, w szczególności na pobieraniu próbek.10-11 ASTM ma również kilka aktywnych elementów roboczych mających na celu opracowanie nowych metod analitycznego wykrywania mikrodrobin plastiku w wodach środowiskowych. ISO ma podobny projekt związany z analizą mikrodrobin plastiku, który odnosi się konkretnie do mikrodrobin plastiku ze źródeł tekstylnych (np. ISO/DIS 4484-2.2).12 Opracowanie metod okazało się wyzwaniem z wielu powodów, w tym z powodu różnorodności technik analizy i znacznej różnorodności próbek. Chociaż istnieją pewne regulacje i przepisy dotyczące mikrodrobin plastiku w różnych częściach świata, istnieje potrzeba większej globalnej współpracy i koordynacji w celu rozwiązania problemu tego wszechobecnego zanieczyszczenia.
W Stanach Zjednoczonych należy zwrócić uwagę na dwa opublikowane standardy analizy. W 2015 r. National Oceanic and Atmospheric Administration (NOAA) opublikowała podręcznik metod pomiaru mikroplastiku w środowisku, który obejmuje (1) przesiewanie i suszenie, (2) eliminację materii organicznej (etap utleniania), (3) separację gęstości, (4) badanie mikroskopowe i (5) analizę grawimetryczną.13 W 2022 r. Kalifornijska Stanowa Rada Kontroli Zasobów Wodnych (SWRCB) zatwierdziła pierwsze na świecie znormalizowane metody testowania mikroplastików w wodzie pitnej. Dwie standardowe procedury operacyjne (SOP) zostały opracowane i zatwierdzone w ramach badania wielolaboratoryjnego: analiza za pomocą spektroskopii w podczerwieni i spektroskopii Ramana.14
Workflow for Analyzing Microplastics
Obecnie nie ma uniwersalnej standardowej metody analizy mikroplastików, co utrudnia porównywanie wyników z różnych badań. Różne podejścia do kwantyfikacji i identyfikacji mikrodrobin plastiku zostały opublikowane i są wykorzystywane głównie przez akademickie i rządowe instytucje badawcze, a także niezależne laboratoria badawcze na całym świecie. Wiele metodologii opiera się na wcześniej opublikowanych raportach NOAA i SWRCB.13,15 Chociaż publikacje te obejmują szeroką gamę matryc, od próbek wody środowiskowej i wody morskiej po wodę pitną, tkanki zwierzęce, żywność i powietrze, prawie wszystkie metody są zgodne z podobnym ogólnym przepływem pracy obejmującym pobieranie próbek, przygotowanie próbek, filtrację, identyfikację wizualną, analizę spektralną lub chromatograficzną oraz analizę danych i raportowanie.16
Pobieranie próbek do analizy mikroplastików
Metoda pobierania próbek silnie zależy od celu (celów) badań, miejsca pobierania próbek i rodzaju badanych mikroplastików. Aby zapobiec zanieczyszczeniu, należy stosować odpowiednie techniki. W przypadku próbek wody i osadów metody pobierania próbek mogą obejmować stosowanie sieci, filtrów i pułapek na osady. Pomimo obfitości badań i publikacji na temat mikrodrobin plastiku, pobieranie próbek jest jedyną częścią procesu, dla której opublikowano standardowe praktyki. Dalsze najlepsze praktyki obejmują odpowiednią objętość wody, minimalizację zanieczyszczenia i stosowanie kontroli pozytywnych.17
W 2020 r. wydano metody ASTM D8332-20 i ASTM D8333-20, które określają protokoły pobierania próbek do identyfikacji i oznaczania ilościowego mikroplastików oraz przygotowania do innych metod analitycznych [spektroskopii w podczerwieni (FTIR), spektroskopii Ramana lub chromatografii gazowej sprzężonej ze spektrometrią mas (GC-MS/MS)].10,11,18 Metoda ASTM 67563 (również w opracowaniu) zawiera wytyczne dotyczące zbierania ścieków komunalnych i oczyszczonych ścieków do analizy mikroplastików. Międzynarodowa Organizacja Normalizacyjna (ISO) opracowuje dwie normy dotyczące pobierania próbek mikrodrobin plastiku w wodzie: (1) ISO/CD 5667-27.2, część 27 opisuje procedurę zbierania zawieszonych cząstek mikroplastiku w różnych matrycach wodnych, takich jak woda pitna, wody powierzchniowe, woda słodka, woda morska, ścieki oczyszczone i nieoczyszczone ścieki oraz (2) ISO/CD 16094-1, która określa ogólne zasady analizy mikroplastiku i zawiera wytyczne dotyczące pobierania próbek tworzyw sztucznych w wodach o niskiej zawartości zawiesiny ogólnej (TSS), takich jak woda pitna, woda gruntowa, woda opadowa, woda powierzchniowa i woda powstająca w wyniku procesów uzdatniania wody.19,20
Przygotowanie próbek do analizy mikroplastików
Po pobraniu próbek należy je przetworzyć i przygotować do analizy. Z wyjątkiem czystych próbek, takich jak woda pitna i woda butelkowana, próbki zwykle zawierają duże ilości zanieczyszczeń organicznych i nieorganicznych oraz cząstek stałych innych niż badane cząstki tworzyw sztucznych. W związku z tym próbki powinny zostać oczyszczone, wzbogacone i/lub zagęszczone przed analizą. W wielolaboratoryjnym badaniu przeprowadzonym przez SWRCB,14 wykorzystano wiele metod przygotowania próbek, ponieważ do tej pory nie ma przepisów, które zawierałyby wytyczne dotyczące tego etapu.
Metody przygotowania próbek można podzielić na trzy kategorie:21
- Fizyczne - metody te są stosowane do próbek osadów w celu zmniejszenia zawartości nieorganicznej i skoncentrowania mikroplastiku. Najpopularniejszą metodą fizyczną jest separacja gęstościowa, która opiera się na różnicach w gęstości między mikroplastikiem a cząstkami osadu. Oddzielanie gęstości uzyskuje się zwykle poprzez mieszanie próbki w stężonych roztworach soli, takich jak chlorek sodu (NaCl), chlorek wapnia (CaCl2), jodek sodu (NaI), chlorek cynku (ZnCl2) lub węglan potasu (K2CO3).22
- Utlenianie chemiczne/mokre - metody te są stosowane w przypadku próbek bogatych w związki organiczne (takich jak ścieki i fauna i flora). Chociaż istnieje wiele różnych strategii, powszechne reakcje chemiczne stosowane do utleniania obejmują ~ 30% (v/v) roztwór nadtlenku wodoru (H2O2) w połączeniu z solami żelaza jako katalizatorem (reakcja Fentona) lub w połączeniu z kwasem siarkowym (H2SO4). Stosowano również stężone mocne zasady (wodorotlenek sodu lub potasu, NaOH, KOH) i stężone roztwory kwasów utleniających (HNO3, HNO3/HClO4).23 Na tym etapie należy wziąć pod uwagę kompatybilność chemiczną wszelkich materiałów eksploatacyjnych, które wchodzą w kontakt z roztworem.
- Enzymatyczne - metody te są stosowane, gdy pożądana jest "łagodniejsza" metoda trawienia, na przykład podczas analizy wrażliwych polimerów syntetycznych, które mogą zostać utracone lub zdegradowane podczas trawienia chemicznego.24
Optymalna metoda przygotowania próbki zależy od złożoności matrycy i zazwyczaj wymaga połączenia technik ekstrakcji zaprojektowanych w celu wyizolowania mikroplastików z matrycy próbki.
Produkcja wody do analizy mikroplastików (MAG)
W Kalifornijskim Podręczniku Polityki, woda do analizy mikroplastików (MAG) ma być używana jako woda odczynnikowa i do płukania wszystkich naczyń laboratoryjnych przed użyciem. Woda MAG jest definiowana jako "woda o wysokiej czystości przefiltrowana przez filtr o wielkości porów 1 μm lub mniejszej (z dowolnego odpowiedniego materiału; odpowiednie są filtry z włókna szklanego)."14 Tabela 1 przedstawia różne typy membran Millipore® o wielkości porów 1 μm lub mniejszej oraz ich skuteczność w zatrzymywaniu kulek polistyrenowych o różnych średnicach (naśladujących mikroplastiki). Zaleca się, aby membrany o retencji 1,0 µm i mniejszej były używane do przygotowania wody MAG; jednak niektóre filtry wgłębne i te o wielkości porów zbliżonej do 1,0 µm, takie jak 1,2 µm MCE, mogą również wystarczająco oczyszczać cząstki o średnicy 0,96 µm.
Tabela 1. Średnia procentowa retencja (średnia ± STDEV, n=3 dyski) kulek polistyrenowych o średnicach 5,09, 0,96, 0,784 µm przez filtry membranowe Millipore® z różnych materiałów i o różnych rozmiarach porów.
Filtracja próbek do analizy mikroplastików
Filtracja polega na przepuszczeniu próbki przez układ z uchwytem filtra i filtrem membranowym, który zatrzymuje mikroplastiki, które można następnie wyizolować i przeanalizować. Rodzaj filtra stosowanego w danej metodzie może mieć wpływ na wyniki eksperymentalne.
Wybór odpowiedniego filtra do zbierania mikrodrobin plastiku nie jest tak prosty, jak mogłoby się początkowo wydawać. Podczas gdy wiele filtrów może z powodzeniem zbierać mikrodrobiny plastiku, należy dokładnie rozważyć wpływ materiału filtracyjnego na powodzenie jakiejkolwiek dalszej analizy. Jednak ci, którzy chcą zbierać mikrodrobiny plastiku na powierzchni filtra, powinni wziąć pod uwagę następujące kwestie:
- Rozmiar porów i retencja: Mikrofiltry o wielkości porów zazwyczaj większej niż 0,2 µm nadają się do analizy mikroplastiku. Jeśli jednak pożądane są określone zakresy wielkości mikroplastiku (na przykład cząstki 1 µm lub większe), bardziej odpowiednie mogą być większe rozmiary porów. Mikrofiltry mają wielkość porów od 0,2 µm do 100 µm.
- Materiał polimerowy: Podczas gdy większość materiałów filtracyjnych jest kompatybilna z próbkami wodnymi, te próbki, które muszą być przygotowane przy użyciu metod trawienia lub separacji gęstości, będą wymagały filtra, który jest chemicznie kompatybilny z odczynnikiem masowym, w którym próbka jest filtrowana. Ponadto należy wziąć pod uwagę marszczenie się membrany, zwijanie się lub inne zmiany morfologiczne po zwilżeniu filtra i/lub wysuszeniu w piecu przed analizą. Wreszcie, niektóre filtry membranowe są wykonane z tych samych składników, co tworzywa sztuczne, które mogą być przedmiotem zainteresowania. Rozważ filtry, które są wolne od cząstek stałych lub włókien.
- Średnica filtra: Filtry o małej średnicy pozwalają na mniejszą powierzchnię do analizy, skracając czas analizy. Jednak im mniejszy filtr, tym mniejsza objętość, którą można zbadać. Ogólnie rzecz biorąc, większe filtry są odpowiednie dla próbek o większej objętości, podczas gdy mniejsze filtry są odpowiednie dla próbek o mniejszej objętości. Filtracja próbek zawierających większe cząstki stałe może być bardziej wydajna w przypadku filtrów membranowych o większej średnicy ze względu na zwiększoną powierzchnię i mniejsze prawdopodobieństwo zatykania.
- Łatwość obsługi: Cieńsze filtry, takie jak poliwęglan, mogą być trudne w obsłudze za pomocą kleszczy, zwłaszcza gdy są zwilżone. Jeśli filtr musi zostać usunięty (fizycznie przeniesiony z zestawu filtracyjnego do innego zestawu analitycznego), mogą być potrzebne grubsze i mocniejsze materiały membranowe, aby uniknąć przypadkowego zagięcia i pomarszczenia. W przypadku niektórych membran niska poręczność może prowadzić do niskiego odzysku cząstek z powodu toczenia się i/lub elektrostatycznego ruchu cząstek z powierzchni filtra podczas transportu. Może to być również spowodowane gładszymi powierzchniami.
Sprzęt do filtracji
Najczęstszą konfigurację do filtracji pokazano na Rysunku 1. Filtr membranowy jest utrzymywany na miejscu w uchwycie filtra, który jest przymocowany do kolby; zacisk zabezpiecza konfigurację. Przy wyborze uchwytu filtra należy wziąć pod uwagę kilka kwestii: wybór zależy od próbki i rodzaju filtra membranowego, który ma być użyty.
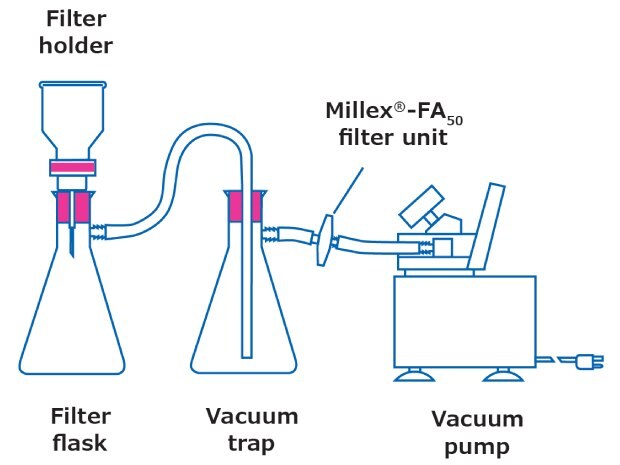
Rysunek 1.Konfiguracja filtracji
- Materiał uchwytu filtra: Zazwyczaj dostępne są uchwyty filtrów ze szkła, stali nierdzewnej i tworzywa sztucznego. Uchwyty filtrów ze stali nierdzewnej mają najszerszą kompatybilność chemiczną. Uchwyty filtrów Hydrosol™ ze stali nierdzewnej mogą być uziemione, a tym samym używane do bezpiecznej filtracji lotnych rozpuszczalników. Konfiguracje szklane są najłatwiejsze i najbardziej wszechstronne, podczas gdy plastikowe uchwyty filtrów są przeznaczone do jednorazowego użytku i utylizacji.
- Średnica i efektywny obszar filtracji: Średnica filtra nie tylko dyktuje obszar filtracji, na którym próbka może zostać rozproszona, ale także objętość próbki, którą można obsłużyć. Odpowiedni rozmiar filtra może ułatwić filtrację. W niektórych przypadkach uchwyt filtra może mieć szklaną frytę z uszczelką PTFE. Ci, którzy chcą uniknąć plastikowych elementów, powinni upewnić się, że ich zestaw filtracyjny jest w całości wykonany ze szkła. Efektywny obszar filtracji (EFA) membrany wystawionej na działanie próbki różni się w zależności od średnicy filtra i konfiguracji uchwytu filtra. Często EFA jest podawana w literaturze produktu.
- Podpora filtra: Podpora (podstawa, na której osadzony jest filtr) może być wykonana z wielu materiałów, w tym z fryty szklanej lub siatki ze stali nierdzewnej. W niektórych przypadkach na zewnątrz znajduje się uszczelka PTFE zapewniająca dodatkową stabilność. Aby uniknąć plastikowych elementów w konfiguracji filtracji, należy upewnić się, że uchwyt filtra jest w całości wykonany ze szkła lub stali nierdzewnej.
- Niespecyficzne wiązanie: Możliwe jest przyleganie mikroplastików do zestawów filtracyjnych. W takim przypadku można zastosować dodatkowe płukanie wodą MAG, zarówno gdy lejek jest zaciśnięty, jak i po delikatnym podniesieniu z filtra przy nadal zastosowanej próżni.
Visual Identification and Spectral or Chromatographic Quantitation
Różne metody są stosowane samodzielnie lub w połączeniu w celu dokładnego oznaczenia ilościowego mikroplastików w matrycach środowiskowych (Tabela 2). Wiele wczesnych badań wykorzystywało mikroskopię świetlną do identyfikacji mikroplastików w próbkach. W tym procesie cząstki były identyfikowane na podstawie koloru i kształtu. Metody fluorescencyjne zostały zaadaptowane i są częściej stosowane.25 Mikroskopia elektronowa może być wykorzystywana do szczegółowej charakterystyki powierzchni. W ciągu ostatnich kilku lat opracowano bardziej zaawansowane techniki, które mogą być stosowane w połączeniu z metodami mikroskopowymi.26 Spektroskopia, taka jak spektroskopia w podczerwieni z transformacją Fouriera (FTIR), Ramana i odmiany tych technik mogą określać strukturę chemiczną określonych typów polimerów (tworzyw sztucznych) i są nieniszczące. Piroliza w połączeniu ze spektrometrią masową chromatografii gazowej (Py-GC/MS) może dostarczyć bardzo szczegółowych informacji na temat składu cząstek, a nawet dodatków w tych cząstkach, ale jest to niszcząca metoda analizy. We wszystkich tych przypadkach membrana filtracyjna jest zwykle używana jako podłoże dla cząstek po ich zebraniu. Różne filtry są lepsze dla niektórych metod niż inne, jak omówiono w następnej sekcji.
Tabela 2. Metody stosowane do analizy mikroplastików.
Analiza danych i raportowanie
Dane zebrane podczas analizy mikroplastików muszą zostać przeanalizowane i zinterpretowane, aby można je było przedstawić w sposób wnikliwy. Może to obejmować analizę statystyczną, mapowanie i inne techniki wizualizacji. Zazwyczaj interesujące jest wykorzystanie danych do nauki:
- Rodzaje i skład polimerów
- Informacje o rozmiarze i kształcie
- Stężenie cząstek
Filter Considerations for Microplastics Analysis
Filtracja odgrywa kluczową rolę w analizie mikroplastików. Filtry są dostępne w szerokiej gamie materiałów membranowych, rozmiarów porów i średnic, aby spełnić różne wymagania metod analitycznych. W wielu przepływach pracy z mikroplastikami membrana filtra nie tylko zbiera cząstki, ale także działa jako podłoże, na którym są one charakteryzowane. Filtry jako podłoże muszą być nieskazitelne, płaskie, umożliwiać optyczne rozpoznawanie cząstek i nie mogą zakłócać analizy, a ponadto muszą mieć odpowiedni rozmiar porów, aby zatrzymać cząstki podczas zbierania.27
Filter Considerations for Microscopy and Optical-Based Methods in Microplastics Analysis
- Interferencja fluorescencyjna
- Przejrzystość optyczna
- Współczynnik załamania materiału filtracyjnego
- Kontrast vs. mikrocząstki plastiku
- Chropowatość lub gładkość powierzchni
- Dla zatrzymania cząstek
- Dla dobrej ostrości obrazu<
- Zmiany struktury powierzchni po zwilżeniu / wysuszeniu
- Obecność włókien
- Siatkowane vs.
- Łatwość przenoszenia od zestawu filtracyjnego do mikroskopu
- Rezydencja cząstek
W wizualizacji i optycznych metodach analitycznych zwykle stosuje się filtry membranowe z włókna szklanego. W przypadku badań pod mikroskopem świetlnym, płaski, gładki i kratkowany filtr membranowy, taki jak optycznie przezroczysty poliwęglan lub optycznie biały MCE, może być ważny dla wizualizacji i liczenia. Jednak w przypadkach, gdy cząstki plastiku są gładkie, bardziej szorstka, grubsza i mocniejsza powierzchnia membrany, taka jak polipropylen, włókno kwarcowe lub włókno szklane, może pomóc w osadzaniu cząstek. W niektórych badaniach wykorzystano czerwień nilową do wykrywania i ilościowego określania mikroplastików ze względu na selektywną adsorpcję barwnika na mikroplastikach i właściwości fluorescencyjne.25 W tym przepływie pracy ważne jest, aby membrana filtra nie wykazywała interferencji fluorescencyjnej lub niespecyficznie absorbowała czerwień nilową. W szczególności w przypadku filtrów z włókna szklanego należy określić, czy obecność włókien na powierzchni membrany zakłóca analizę cząstek włókien.
Wykazaliśmy, że nasza membrana z włókna szklanego Millipore® 1.0 µm filtr membranowy z włókna szklanego nadaje się do stosowania w metodach Nile Red do ilościowego oznaczania cząstek plastiku w wodzie pitnej (Rysunek 2-3) przy użyciu dostosowanej metody.25

A) Filtr z włókna szklanego Millipore® 1,0 µm, powtórzenie 1

B) Filtr z włókna szklanego Millipore® 1,0 µm, powtórzenie 2

C) Filtr z włókna szklanego Millipore® 1,0 µm, powtórzenie 3

D) Kontrolny filtr z włókna szklanego 1,5 µm
Rysunek 2. Reprezentatywne obrazy mikroplastików w niebieskim świetle przy użyciu barwnika fluorescencyjnego Nile Red zebrane na Millipore® 1.0 µm (repliki 1-3 w A-C, odpowiednio) w porównaniu z tymi zebranymi za pomocą membrany z włókna szklanego 1,5 µm (D) sugerowanej w opublikowanej metodzie.25

Rysunek 3.Średnią liczbę cząstek określono w pięciu frakcjach wielkości mikroplastiku o średnicy od 6,5 µm do 1 mm na każdej membranie.
Różne inne membrany zostały zbadane pod kątem kontrastu i przejrzystości optycznej podczas obrazowania modelowych mikroplastików. Stwierdzono, że białe włókno szklane, włókno kwarcowe, zarówno biały, jak i przezroczysty poliwęglan (PC), czarny mieszany ester celulozy (MCE) i białe membrany filtracyjne MCE wykazały dobrą retencję cząstek w odpowiednich zakresach wielkości (patrz Tabela 1), jednocześnie wykazując jakość obrazowania (Rysunek 4 i Rysunek 5). Filtry z włókna szklanego i kwarcowego mają szorstkie powierzchnie, które były dobre do wychwytywania i zatrzymywania mikrocząstek podczas transportu, podczas gdy PC i MCE wykazały gładkie powierzchnie, które były dobre do skutecznego charakteryzowania cząstek. Podczas gdy filtry z włókna szklanego i włókna kwarcowego nie wykazywały wizualnych różnic po wysuszeniu na powietrzu lub w piecu (65°C) po zwilżeniu, czarny MCE stał się ciemniejszy, podczas gdy PC wykazywał znaki wodne po wysuszeniu. Osiągnięcie prawidłowego kontrastu i oświetlenia przy niskich powiększeniach (Rysunek 4) było trudne przy użyciu PC ze względu na jego błyszczącą powierzchnię, co ostatecznie czyni go bardziej odpowiednim do warunków mikroskopii elektronowej lub wyższych powiększeń (Rysunek 5).

Rysunek 4.Reprezentatywne obrazy modelowych mikroplastików na filtrach z włókna szklanego 1,0 µm (A), filtrach z włókna kwarcowego (B), filtrach z poliwęglanu 0,8 µm (C), filtrach z poliwęglanu 8.0 µm filtry poliwęglanowe (D), 0,8 µm czarne mieszane filtry estrów celulozy (E) i 1,2 µm mieszane filtry estrów celulozy (F). Rzędy od lewej do prawej wskazują czysty filtr zwilżony w buforze PBS i suszony na powietrzu (przez noc), filtr z mikroplastikami zwilżony w buforze PBS i suszony na powietrzu (przez noc), czysty filtr zwilżony w buforze PBS i suszony w piecu przez 1 godzinę w temperaturze 65°C oraz filtr z mikroplastikami zwilżony w buforze PBS i suszony w piecu przez 1 godzinę w temperaturze 65°C. Powiększenie 20x, słupek = 107 µm.

Rysunek 5.Reprezentatywne obrazy modelowych mikroplastików na filtrach z włókna szklanego 1,0 µm (A), filtrach z włókna kwarcowego (B), filtrach z poliwęglanu 0,8 µm (C), filtrach z poliwęglanu 8.0 µm filtry poliwęglanowe (D), 0,8 µm czarne mieszane filtry estrów celulozy (E) i 1,2 µm mieszane filtry estrów celulozy (F). Rzędy od lewej do prawej wskazują czysty filtr zwilżony w buforze PBS i suszony na powietrzu (przez noc), filtr z mikroplastikami zwilżony w buforze PBS i suszony na powietrzu (przez noc), czysty filtr zwilżony w buforze PBS i suszony w piecu przez 1 godzinę w temperaturze 65°C oraz filtr z mikroplastikami zwilżony w buforze PBS i suszony w piecu przez 1 godzinę w temperaturze 65°C. Powiększenie 100x, słupek = 100 µm.
Filtry do spektroskopii IR
- Interferencja spektralna
- Maskowanie sygnału
- Grubość
- Refleksyjność
- Wzmocnienie sygnału
- Kompatybilność z laseremGrubość
- Łatwość obsługi i kruchość
Przetestowano szereg różnych typów filtrów, aby określić, który z nich najlepiej nadaje się do analizy mikroplastików w podczerwieni. W pomiarach odbicia wykazano, że powlekana złotem membrana poliwęglanowa zapewnia dobrą wydajność. W metodzie SWRCB, metodzie bazowej, na podstawie której opracowywane są nowe metody ASTM, zarówno metody FTIR, jak i spektroskopii Ramana sugerują stosowanie membran poliwęglanowych.14
Badanie warunków instrumentalnych FTIR do charakterystyki mikroplastików wykazało, że siatki ze stali nierdzewnej skutecznie zbierały mikroplastiki i umożliwiały ich analizę za pomocą mikroskopii FTIR z niewielkimi zakłóceniami spektralnymi ze względu na ich wysoce odblaskowy charakter, podczas gdy filtry z włókna szklanego i estru celulozy wykazywały zakłócenia spektralne przy różnych długościach fali.28 Rysunek 6 przedstawia przykładowe widma tła ATR-FTIR dla różnych typów filtrów omówionych w tym artykule, w tym włókna szklanego i kwarcowego, poliwęglanu i mieszanej celulozy.
![Background IR Spectra of Membrane Filters Tło widm IR [absorbancja (0-1,0)] vs. liczba falowa (cm-1) dla różnych membran filtracyjnych omówionych w tym artykule. A) 1,0 µm włókno szklane, B) 0,7 µm włókno szklane, C) włókno kwarcowe, D) 0,4 µm czarny poliwęglan, E) 0,8 µm biały poliwęglan, F) 8,0 µm przezroczysty poliwęglan, G) 0,8 µm czarny mieszany ester celulozy w kratkę, H) 1,2 µm biały mieszany ester celulozy, I) 0,45 µm hydrofilowy PTFE, J) 0,45 µm hydrofilowy polipropylen.](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/environmental-testing-and-industrial-hygiene/background-ir-sepectra-membrane-filters/background-ir-sepectra-membrane-filters.jpg)
Rysunek 6.Tło widm IR [absorbancja (0-1,0)] vs. liczba falowa (cm-1) dla różnych membran filtracyjnych omówionych w tym artykule. Od góry do dołu: 1.0 µm włókno szklane, 0.7 µm włókno szklane, włókno kwarcowe, 0.4 µm czarny poliwęglan, 0.8 µm biały poliwęglan, 8.0 µm przezroczysty poliwęglan, 0.8 µm czarny kratkowany mieszany ester celulozy, 1.2 µm biały mieszany ester celulozy, 0,45 µm hydrofilowy PTFE i 0,45 µm hydrofilowy polipropylen. iD7 ATR (Thermo Fisher Scientific), tryb systemu: odbicie, ATR, rozdzielczość 4 cm-1; 16 skanów.
Uwagi dotyczące filtrów do spektroskopii Ramana
Filtry do analizy Ramana nie powinny wykazywać żadnych pasm w zakresie spektralnym badanego materiału polimerowego (mikroplastiku) i nie powinny być fluorescencyjne. Powlekane złotem filtry z poliwęglanu, tlenku glinu, krzemu i włókna szklanego zostały przebadane pod kątem analizy mikroplastików za pomocą spektroskopii Ramana. Powlekane złotem filtry poliwęglanowe są sprzedawane do celów badawczych, ale podobnie jak srebro i inne powlekane membrany, są drogie. Możliwe jest również zobaczenie pików poliwęglanu przez złoto. Filtry z tlenku glinu są stosunkowo tańsze, ale wykazują słaby profil fluorescencji, który może zakłócać analizę.29 Filtry krzemowe są sztywne i zapewniają dobre widoczne obrazy, ale piki krzemowe są obecne w widmach. Filtry te nie są powszechnie dostępne. Włókno szklane jest niedrogie, ale jego powierzchnia nie jest wystarczająco gładka, aby cząsteczki były dobrze widoczne. Podobnie, powszechne jest analizowanie na szklanych szkiełkach, ale jeśli potrzebne jest frakcjonowanie wielkości i przygotowanie próbki, musi istnieć sposób na łatwe pobieranie próbek lub przenoszenie cząstek mikroplastiku z powierzchni filtra na szklane szkiełko.
Uwagi dotyczące filtrów do GC/MS i pirolizy-GC/MS
- Średnica filtra
- Możliwość dopasowania do kubka do pirolizy
- Subsampling
- Wytrzymałość
- Tło
Wysoce czułe analizy mogą być wykonywane na mikroplastikach przy użyciu GC-MS. Filtry membranowe z włókna szklanego i kwarcowego są stosowane w metodach py-GC/MS. Ponieważ przygotowanie próbki do pirolizy wykorzystuje pirolizę do rozbicia polimerów na mniejsze cząsteczki, piroliza może zidentyfikować nie tylko monomer polimeru, ale także wszelkie dodatki stosowane w produkcji do barwienia i innych dodatkowych właściwości. Chociaż jest to wysoce wymierne przy użyciu różnych istniejących bibliotek mikroplastików, powierzchnia używana do zbierania mikroplastików - filtr membranowy - powinna wykazywać niskie i / lub wysoce rozróżnialne tło od podejrzanych polimerów mikroplastikowych. Próbka musi być również wystarczająco mała, aby zmieścić się w typowym kubku do pirolizy (średnice w skali milimetrowej). Może to być trudne w przypadku stosowania filtrów z włókna szklanego bez spoiwa lub filtrów z włókna kwarcowego, gdzie 25 mm jest zazwyczaj najmniejszym dostępnym rozmiarem dysku. Filtry wgłębne z włókna szklanego używane do badań grawimetrycznych i zawiesin (takie jak AP400100) mogą w wielu przypadkach działać równie dobrze jak mikrofiltry i są dostępne w średnicach tak małych jak 10 mm. Jeśli małe średnice nie są dostępne, część (13 mm lub 4 mm) można wyciąć z większej średnicy lub arkusza membrany, lub cały filtr można złożyć i umieścić wewnątrz kubka. Podczas gdy py-GC/MS jest bardzo dokładny, tylko niewielka część próbki może być analizowana.
Mikroplastiki są nowymi zanieczyszczeniami występującymi wszechobecnie w środowisku, faunie i florze, żywności i napojach, a nawet w tkankach ludzkich. Obecnie nie ma uniwersalnych standardów zbierania, przetwarzania i analizowania próbek, pomimo setek prac badawczych opublikowanych na ten temat. Organizacje takie jak ASTM i ISO opracowują standardowe metody, aby zaspokoić tę potrzebę. Istnieje wiele różnych metod analizy służących do badania wielkości, stężenia i rodzaju mikroplastiku; jednak we wszystkich przypadkach preferowaną metodą oddzielania różnych rozmiarów cząstek jest membrana filtracyjna, która służy jako podłoże do charakterystyki. Każda metoda wymaga innych rozważań przy wyborze filtra membranowego i uchwytu filtra. Chociaż istnieje wiele różnych podejść do zbierania, przygotowywania i analizowania mikrodrobin plastiku w różnych matrycach środowiskowych, najlepszym rozwiązaniem będzie prawdopodobnie połączenie metod wizualnych, spektroskopowych i chromatograficznych.
Tabela doboru filtrów do analizy mikroplastików
Inne materiały membranowe, rozmiary porów i średnice filtrów są również dostępne.
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?