Często zadawane pytania dotyczące chromatografii spiralnej
Czytaj więcej o
- Chirality & Chiral Chromatography
- Chiral HPLC Column Selection & Screening
- Astec CHIROBIOTIC Chiral HPLC
- Astec CYCLOBOND Chiral HPLC.
- Preparative Chiral HPLC
- Tips and Tricks for Chiral HPLC
- Chiralna GC
Chirality & Chiral Chromatography
Co to jest chiralność?
Chiralność należy do dyscypliny stereochemii, która zajmuje się badaniem trójwymiarowej struktury cząsteczek. Związki chiralne są aktywne optycznie, co oznacza, że obracają spolaryzowane światło w lewo lub w prawo w zależności od ich konfiguracji. Słowo to pochodzi od greckiego rdzenia "chir-" oznaczającego rękę. Cząsteczki chiralne są jak lewa i prawa ręka - są lustrzanymi odbiciami. Żaden obrót nie jest w stanie sprawić, że oba obrazy lub cząsteczki nałożą się na siebie. Związek chiralny będzie obracał płaszczyznę światła spolaryzowanego; stopień, w jakim to robi, nazywany jest specyficzną rotacją lub rotacją optyczną.
Jakie są rodzaje izomerów? Izomery to cząsteczki o tym samym wzorze chemicznym i często z tymi samymi rodzajami wiązań między atomami, ale w których atomy są ułożone inaczej. Słowo to pochodzi od greckiego "isomeres" oznaczającego równy udział. Izomery mogą być strukturalne lub przestrzenne (stereoizomery). W izomerach strukturalnych atomy i grupy funkcyjne są połączone ze sobą na różne sposoby. Na przykład pentan może występować jako trzy izomery strukturalne: n-pentan, izopentan i neopentan; związki orto-, meta- i para-podstawione są również izomerami strukturalnymi. Stereoizomery (izomery przestrzenne) to izomery tej samej substancji, które różnią się jedynie przestrzennym rozmieszczeniem atomów. Maksymalna liczba stereoizomerów, które mogą istnieć dla związku wynosi 2n, gdzie n jest liczbą centrów chiralnych. Centra chiralne to atomy, zwykle C, związane z czterema różnymi grupami. Stereoizomery, które różnią się kierunkiem, w którym obracają płaszczyznę spolaryzowanego światła, nazywane są optycznie aktywnymi lub chiralnymi, a ich izomery nazywane są enancjomerami. Wszystkie enancjomery są stereoizomerami, ale nie wszystkie stereoizomery są enancjomerami. Enancjomery obracają płaszczyznę spolaryzowanego światła - jeden enancjomer w lewo, drugi w prawo. Enancjomery nie są nakładającymi się na siebie lustrzanymi odbiciami. Diastereomer (lub diastereoizomer) to cząsteczki, które posiadają więcej niż jedno centrum chiralne. Diastereomery mogą być enancjomerami, jeśli są lustrzanymi odbiciami. Jeśli nie, są po prostu diastereomerami, które różnią się właściwościami chemicznymi i można je rozdzielić konwencjonalnymi metodami. Anomery to diastereomery, które różnią się tylko konfiguracją pierwszego atomu C. Epimery to diastereomery, które różnią się tylko konfiguracją drugiego atomu C. Mezozwiązki posiadają dwa centra chiralne, ale nie są aktywne optycznie, ponieważ rotacja spowodowana przez jedno centrum jest dokładnie równoważona przez rotację w drugim centrum. Przez środek cząsteczki przebiega płaszczyzna symetrii; jedna połowa cząsteczki jest lustrzanym odbiciem drugiej.
Co to jest racemat? Racemizacja to utrata czystości enancjomerycznej. Rozpoczyna się od pojedynczej formy enancjomerycznej, ale kończy się mieszaniną enancjomerów (racematem). Może być spowodowana podwyższoną temperaturą lub konwersją biologiczną.
Mieszaniny racemiczne to mieszaniny enancjomerów (+) i (-) w równych proporcjach. Otrzymują oznaczenie +/-, R/S, d/l lub D/L w zależności od rodzaju związku. Mieszaniny racemiczne są optycznie nieaktywne.
Jaka nomenklatura jest używana do rozróżniania enancjomerów? (+) i (-) są eksperymentalnie weryfikowane przez kierunek, w którym cząsteczka obraca spolaryzowane światło. (+) oznacza obrót zgodny z ruchem wskazówek zegara, (-) oznacza obrót przeciwny do ruchu wskazówek zegara.
(R) i (S) (rectus i sinister) opierają się na kierunku grup priorytetowych wokół C, z najniższą grupą priorytetową skierowaną w dal.
W (d) i (l), (D) i (L) D lub D oznacza "dekstro" oznaczające "prawy" i odnosi się do obrotu zgodnie z ruchem wskazówek zegara, l lub L oznacza "levo" oznaczające "lewy" i odnosi się do obrotu przeciwnego do ruchu wskazówek zegara. Aminokwasy, cukry i pokrewne związki nadal odnoszą się do oznaczenia D,L. System ten, wynaleziony przez Emila Fishera, odnosi się do konfiguracji gliceraldehydu. Arbitralnie przypisał on izomer + gliceraldehydu jako izomer D. Oznaczenia d i l odnoszą się do rotacji światła spolaryzowanego płaszczyznowo (sodowa linia d). Jeśli to światło jest obrócone w prawo, oznaczeniem jest "d" lub (+). Przypisanie to wiąże się z problemami, ponieważ kwas D-glutaminowy jest w rzeczywistości l lub (-) dla rotacji światła spolaryzowanego. Należy zachować szczególną ostrożność podczas używania tych symboli, ponieważ można je powiązać ze sobą dopiero po eksperymentalnym określeniu rzeczywistej rotacji (+ lub -).
Dlaczego firmy dbają o czystość chiralną swoich związków? Poza faktem, że jeden enancjomer jest często bezpieczniejszy i bardziej skuteczny niż drugi enancjomer, istnieją inne argumenty przemawiające za posiadaniem optycznie czystych związków. (1) Dawkowanie jest niższe. Jeśli produkt zawiera niechciany lub nieaktywny enancjomer, wówczas należy dawkować dwa razy więcej niż w przypadku posiadania tylko czystego aktywnego enancjomeru. (2) Brak zakłóceń pożądanej aktywności przez niepożądany enancjomer. W wielu przypadkach niepożądany enancjomer ma inną aktywność biologiczną i zakłóca działanie zamierzonego enancjomeru. (3) Oszczędność czasu podczas testowania. Jeśli ich produkt zawiera więcej niż jeden enancjomer, muszą sprawdzić aktywność biologiczną każdego izomeru oraz racematu, aby sprawdzić efekty kooperacji. To trzy razy więcej pracy niż testowanie czystego enancjomeru! Argumenty te są prawdziwe dla innych branż poza farmaceutyczną, na przykład agrochemiczną. Ma to wpływ na środowisko, ponieważ może wpływać na całkowitą ilość chemikaliów stosowanych do uprawy.
Jak uzyskuje się czyste enancjomery? Ponieważ wiele związków może występować jako dwa lub więcej enancjomerów, w jaki sposób chemicy uzyskują czysty enancjomer? Ogólnie rzecz biorąc, stosowane są dwie techniki: Syntetycznie i postsyntetycznie. (1) Syntetycznie. Unikanie mieszanin racemicznych poprzez stosowanie chiralnie czystych materiałów wyjściowych (syntonów), syntezę asymetryczną, katalizę chemiczną lub biokatalizę. (2) Postsyntetycznie przy użyciu chromatografii. Chiralne fazy stacjonarne (HPLC i SFC) mogą rozdzielać mieszaniny racemiczne na poszczególne izomery i mogą być skalowane do rozmiarów preparatywnych. Enancjomery można przekształcić w diastereomery za pomocą chiralnego odczynnika derywatyzującego lub za pomocą chiralnych dodatków do fazy ruchomej, a następnie rozdzielić za pomocą konwencjonalnej HPLC lub GC. Metoda ta nie jest jednak często stosowana w przemyśle, ponieważ wymaga chiralnie czystego odczynnika derywatyzującego, a szybkość reakcji z każdym enancjomerem musi być identyczna. Jeśli możliwa jest symulacja przygotowania ruchomego złoża (SMB), koszty spadają. Dostępne stają się nowe technologie enzymatyczne (ciągłe), które przekształcają niepożądany izomer z powrotem w racemat do dalszego przygotowania. Najpopularniejszą metodą rozdzielania mieszanin racemicznych dla operacji na skalę procesową jest nadal krystalizacja soli diastereomerycznych.
Co to jest stosunek "e/e"? "e/e" odnosi się do stosunku jednego enancjomeru do drugiego w związku. Na przykład, w prep chiralnej HPLC, "czysty" enancjomer może wynosić 98% e/e.
Jak działa chromatografia chiralna? Enancjomery tego samego związku mają identyczne właściwości fizyczne. Różnią się jedynie: (1) kierunkiem rotacji światła spolaryzowanego, (2) aktywnością biologiczną (niektóre) oraz (3) interakcją z innymi chiralnymi cząsteczkami, takimi jak chiralne fazy stacjonarne (CSP) w separacjach chromatograficznych. Wykorzystanie tego ostatniego punktu do faktycznego rozdzielenia i ilościowego oznaczenia enancjomerów jest funkcją chromatografii chiralnej.
Jakie detektory są używane ze związkami chiralnymi? Dostępne są detektory HPLC, które są specyficzne dla wykrywania i pomiaru związków chiralnych. Detektory te (zarówno in-line, jak i off-line) są używane do pomiaru zawartości enancjomerów w piku lub oczyszczonej próbce
Stosowane są dwa rodzaje detektorów chiralnych: Polarymetry i spektrometry dichroizmu kołowego.
Co to jest Polar Ionic Mode (PIM)?
Jest to system fazy ruchomej unikalny dla CHIROBIOTIC CSP. Jest on definiowany jako polarny rozpuszczalnik organiczny (np. metanol) zawierający rozpuszczalne sole, takie jak octan amonu. Nowatorski i bardzo wszechstronny polarny tryb jonowy jest cenną cechą CSP Astec CHIROBIOTIC, ponieważ jego fazy ruchome są polarnymi rozpuszczalnikami organicznymi zawierającymi lotne dodatki, które idealnie nadają się do zastosowań preparatywnych i LC-MS. W porównaniu do separacji w normalnej fazie, polarny tryb jonowy ma zalety szybkości, wydajności i czułości, wszystkie cenne zalety dla LC-MS.
Co to jest polarny tryb organiczny (POM)? Fazy ruchome, które są polarnym rozpuszczalnikiem organicznym lub mieszanką rozpuszczalników. Enancjomery polarnych, neutralnych analitów zostały z powodzeniem rozdzielone w Astec CHIROBIOTIC w trybie polarno-organicznym Mieszaniny reakcyjne, nawet w pirydynie, mogą być uruchamiane w Astec CHIROBIOTIC w tym trybie.
Dlaczego POM jest przydatny w chiralnej HPLC & LC/MS? Korzyść z POM jest realizowana, gdy mamy do czynienia ze związkami, które są słabo rozpuszczalne w niepolarnych fazach ruchomych. W przypadku preparatywnych zastosowań chiralnych rozpuszczalność jest szczególnie ważna; stężenie analitu na wstrzyknięcie wpływa na przepustowość. Fazy ruchome POM są również przyjazne dla specyfikacji masowej, ponieważ wykorzystują eluenty na bazie metanolu z pewną ilością kwasu i zasady lub lotnych soli amonowych jako dodatków. Dodatkową zaletą jest to, że linie bazowe POM są generalnie mniej zaszumione niż linie bazowe fazy normalnej. Równoważenie kolumny i systemu w fazach ruchomych POM jest również bardzo szybkie i nie występuje efekt pamięci.
Z jakimi rodzajami CSP można stosować POM? Efekt POM został po raz pierwszy opisany przez Armstronga na początku lat 90-tych (1-3) na natywnych i pochodnych CSP na bazie cyklodekstryny (np. Astec CYCLOBOND). Jednak każdy CSP, który może oddziaływać z substancjami rozpuszczonymi poprzez mechanizmy wiązania wodorowego, może wykorzystywać POM. Te CSP obejmują cyklodekstryny, a także makrocykliczne glikopeptydy (np. Astec CHIROBIOTIC) i polisacharydy (np. Astec Cellulose DMP).
Czy POM może być stosowany z popularnymi CSP na bazie celulozy? Tak! Chociaż fazy oparte na polisacharydach (celuloza i amyloza) dowiodły swojej wartości w fazach normalnych i systemach SFC, odkryliśmy, że mają dobrą selektywność w stosunku do związków racemicznych w fazach ruchomych POM.
Czy POM jest realną alternatywą dla fazy normalnej?
Separacje w POM mogą być bardziej wydajne i zapewniać większą rozdzielczość niż w trybie NP. Chociaż jest to bardzo zależne od związku, POM należy zbadać, jeśli pożądana jest poprawa rozpuszczalności, czułości lub kompatybilności z aparaturą. Rysunek 1 i Rysunek 2 przedstawiają antydepresyjną mianserynę i Tröger's Base na Astec Cellulose DMP (celuloza diwinianowana 3,5-difenylokarbaminianem) w fazie normalnej i systemach POM. Należy zauważyć, że w obu przypadkach separacja POM dała porównywalną retencję, ale lepszą rozdzielczość i ostrzejsze piki.

Rysunek 1. Porównanie NP i POM na Astec Cellulose DMP (Mianserin) Faza ruchoma: Patrz rysunek
Kolumna: Astec Cellulose DMP, 15 cm x 4,6 mm I.D., cząstki 5 µm (Nr produktu 51098AST)
Natężenie przepływu: 0,5 mL/min
Det. UV przy 230 nm
Próbka: Mianserin, 2 mg/ml

Rysunek 2. Porównanie NP i POM na Astec Cellulose DMP (Tröger's Base)
Kolumna: Astec Cellulose DMP, 15 cm x 4,6 mm I.D., cząstki 5 µm (Nr produktu 51098AST)
Faza ruchoma: Patrz rysunek
Prędkość przepływu: 0,5 mL/min.
Det. UV przy 230 nm
Próbka: Baza Trögera, 2 mg/ml
Chiral HPLC Column Selection & Screening
Jak wybrać kolumnę chiralną?
Możesz sprawdzić, czy separacja pojawia się w naszej bazie danych aplikacji lub została opublikowana w literaturze. Przeszukaj naszą stronę internetową lub skontaktuj się z naszym działem usług technicznych. Jeśli jednak masz nowy związek, będziesz musiał przesiać kolumny. Można sprawdzić, czy istnieją opublikowane metody dotyczące związków powiązanych strukturalnie, ale podobieństwo strukturalne nie gwarantuje podobnego zachowania na chiralnych fazach stacjonarnych. Najbardziej efektywnym podejściem jest skontaktowanie się z naszą grupą usług chiralnych. Jesteśmy w pełni wyposażeni do przeprowadzania badań przesiewowych kolumn, optymalizacji metod i usług oczyszczania. Jeśli chcesz wykonać pracę samodzielnie, wybierz HPLC, SFC lub GC. Następnie możemy poprowadzić Cię do właściwego zestawu kolumn, które należy uwzględnić w protokole badań przesiewowych, oraz systemów, które należy zastosować.
Jakiego rodzaju podejście powinienem przyjąć do sprawdzania kolumn chiralnych?
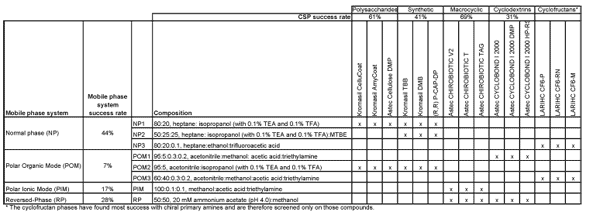
Nawet eksperci muszą sprawdzać kolumny. Nie ma niezawodnego sposobu na wybór kolumny chiralnej opartej wyłącznie na strukturze analitu. Nasze laboratorium usług chiralnych nieustannie eksperymentuje ze sposobami poprawy skuteczności protokołów przesiewowych kolumn chiralnych. Obecnie wskaźnik sukcesu wynosi 94% dla zróżnicowanego strukturalnie, 32-składnikowego zestawu przesiewowego (Tabela 1). Opis naszego protokołu przesiewowego i wskaźniki sukcesu lub "trafień" przedstawiono w Tabeli 2. Używamy dwóch instrumentów HPLC, jednego dedykowanego do pracy w fazie normalnej (NP), a drugiego do pracy w fazie odwróconej (RP), w trybie polarnym jonowym (PIM) i polarnym organicznym (POM). Polisacharydowe i syntetyczne polimery CSP są badane w systemach NP i POM. CSP Astec CYCLOBOND są badane w POM i RP. CSP Astec CHIROBIOTIC są również badane w trybie RP, ale są najbardziej przydatne w PIM. PIM jest unikalny dla CHIROBIOTIC i bardzo cenny dla enancjorozdzielania związków polarnych i jonowych. Kiedy napotykamy anality z pierwszorzędową grupą aminową (zwłaszcza taką, która znajduje się w centrum chiralnym lub w jego pobliżu), używamy trzeciego systemu ruchomego NP i trzeciego POM i badamy trzy cyklofruktany CSP. Wszystkie nasze kolumny są bardzo wytrzymałe i nie muszą być dedykowane do pracy w jednym układzie faz ruchomych. Ten krótki opis naszego protokołu przesiewowego ma na celu zademonstrowanie dwóch punktów. Po pierwsze, selektywność fazy stacjonarnej jest największą dźwignią wpływającą na enancjorozdzielczość. Po drugie, posiadanie szerokiej gamy opcji fazy ruchomej, od wysoce polarnych systemów jonowych i wodnych do niepolarnych, zapewnia elastyczność z detektorami i sposobem na zwiększenie rozpuszczalności analitu. To ostatnie jest bardzo ważnym czynnikiem przy przygotowywaniu separacji chiralnych.
Czy macie jakąś bazę aplikacji do wyszukiwania kolumn i warunków?
Tak! Nieustannie dodajemy aplikacje chiralne na naszej stronie internetowej. Zazwyczaj wyszukiwanie w Google wyświetla nasze aplikacje. Możesz jednak wejść na naszą stronę internetową, wpisać nazwę związku w pasku wyszukiwania (dodaj "enancjomer", aby zawęzić wyszukiwanie). Jeśli mamy aplikację, pojawi się ona w zakładce "Aplikacja analityczna". Możesz również przeszukać naszą bibliografię chiralną, w której staramy się utrzymywać aktualną listę miejsc, w których nasze kolumny były cytowane w literaturze naukowej. Lub odwiedź stronę sigma-aldrich.com/applications-search.
Czy możemy wybrać kolumnę do naszego zastosowania w oparciu o opublikowane odniesienie dla innego analitu o podobnej grupie funkcyjnej? Podobieństwo strukturalne nie gwarantuje podobnego zachowania na chiralnych fazach stacjonarnych. Jeśli nie możesz znaleźć dokładnego dopasowania związku, będziesz musiał przesiać kolumny lub zadzwonić do naszej grupy usług chiralnych. Nasza karta ścienna do opracowywania metod chiralnych zawiera pewne wskazówki dotyczące optymalizacji metod w przypadku kwaśnych, zasadowych lub neutralnych analitów.
Jaka konkretna kolumna i faza ruchoma rozdzieli określony zestaw enancjomerów?
Ludzie myślą, że chemia chiralna jest prosta i sucha i że powinniśmy być w stanie po prostu spojrzeć na związek i powiedzieć im, co zapewni enancjomeryczną selektywność. Niestety, jak wiadomo, zwykle tak nie jest. Zazwyczaj zalecamy przesiewanie chiralne, jeśli nie mamy żadnych zastosowań dla tego konkretnego analitu.
Która kolumna jest najlepsza z całej listy chiralnej, którą można wypróbować do wielu zastosowań? Dla HPLC zalecamy kolumnę celulozową (Astec Cellulose DMP lub Kromasil CelluCoat), Astec CHIROBIOTIC V2, T i TAG. Te 4 CSP pozwolą rozdzielić zdecydowaną większość enancjomerów w różnych warunkach fazy ruchomej. W przypadku GC zalecamy Astec CHIRALDEX G-TA, G-DP, B-DM i Supelco ß-Dex 110 lub 120.
Jaka kolumna jest odpowiednikiem {konkretnej kolumny konkurencyjnej}?
Niestety rzadko zdarza się, aby kolumny chiralne były wymienne. Mechanizmy retencji chiralnej są złożone.
Czy macie jakąś równoważną kolumnę, która będzie pasować do kolumn Daicel?
Wszystkie kolumny chiralne są różne. Jednak pod względem selektywności oferujemy Astec Cellulose DMP i Kromasil® CelluCoat™ (dostępne tylko w USA i Kanadzie) które działają podobnie do CHIRALCEL® OD-H i faz opartych na technologii celulozy derywatyzowanej DMPC.
W przypadku kolumn CHIROBIOTIC i CYCLOBOND (oraz wszystkich naszych kolumn), w jaki sposób mogę z powodzeniem dodać te kolumny do mojej obecnej kolumny przesiewowej, z warunkami do szybkiego i łatwego opracowania metody?
Oferujemy Method Development chart który w prosty i przejrzysty sposób pokazuje, jak włączyć Astec CSP do protokołu przesiewowego oraz jak opracować i zoptymalizować metody. Zobacz sekcje FAQ dotyczące CHIROBIOTIC i CYCLOBOND aby uzyskać wskazówki dotyczące opracowywania i optymalizacji metod na tych fazach.
Jestem zainteresowany dodaniem waszych kolumn do moich chiralnych sit, ale jak mogę to zrobić, jeśli mój system jest skonfigurowany do fazy normalnej, a nie odwróconej?
W przypadku fazy normalnej i SFC należy uwzględnić nasze kolumny celulozowe (Astec Cellulose DMP, Kromasil Cellucoat), Astec P-CAP i P-CAP-DP oraz Astec CYCLOBOND I 2000 DMP i DNP. Należy również rozważyć korzyści płynące z zastosowania trybu polarno-jonowego (PIM) i trybu fazy odwróconej dla związków polarnych/jonowych oraz w celu optymalizacji rozpuszczalności analitu i kompatybilności z LC-MS.
Jakie kolumny polecacie do chiralnej chromatografii cieczowej (SFC)? Każda kolumna, która może pracować w fazie normalnej, może pracować w SFC. Do fazy normalnej i SFC należą nasze kolumny celulozowe (Astec Cellulose DMP, Kromasil Cellucoat), Astec P-CAP i P-CAP-DP oraz Astec CYCLOBOND I 2000 DMP i DNP.
Astec CHIROBIOTIC Chiral HPLC
Czym jest rodzina Astec CHIROBIOTIC?
Jak CSP Astec CHIROBIOTIC rozdzielają enancjomery? CSP Astec CHIROBIOTIC oferują sześć różnych rodzajów oddziaływań molekularnych: jonowe, wiązania H, π-π, dipolowe, hydrofobowe i steryczne. Posiadają również wiele miejsc inkluzji, które wpływają na selektywność w oparciu o kształt molekularny analitu. Optymalizację rozdzielczości enancjomerycznej uzyskuje się poprzez zmianę fazy ruchomej w celu wykorzystania rodzajów i względnej siły różnych oddziaływań.
Czym różnią się CSP Astec CHIROBIOTIC? Różne fazy Astec CHIROBIOTIC mają te same zalety: wytrzymałość, elastyczność w opcjach fazy ruchomej, oddziaływania jonowe, kompatybilność ze związkami polarnymi i LC-MS oraz skalowalność preparatywną. Jednak fazy CSP Astec CHIROBIOTIC różnią się selektywnością, głównie ze względu na różną liczbę i rodzaje miejsc interakcji oraz liczbę, rodzaj i dostępność miejsc jonowych w związanym makrocyklicznym glikopeptydzie.
Co sprawia, że fazy CSP Astec CHIROBIOTIC są wyjątkowe?
Sam związany makrocykliczny glikopeptyd, pod względem morfologii, składu molekularnego i wielu wiązań kowalencyjnych z powierzchnią krzemionki, jest tym, co czyni CSP Astec CHIROBIOTIC wyjątkowymi i daje im znaczące i cenne korzyści w porównaniu z innymi CSP. Prawdziwą cechą wyróżniającą Astec CHIROBIOTIC CSP jest obecność interakcji jonowych. Interakcje te są unikalne dla CSP Astec CHIROBIOTIC i są w dużej mierze odpowiedzialne za ich pożądane właściwości retencyjne w stosunku do polarnych i jonizowalnych analitów w rozpuszczalnikach wodnych i niewodnych.
Jaka jest różnica między CSP CHIROBIOTIC? CSP CHIROBIOTIC są oparte na różnych makrocyklicznych glikopeptydach (naturalnych produktach pochodzenia mikrobiologicznego). Obecnie oferujemy 4 różne: teikoplaninę, wankomycynę, ristocetynę i aglikon teikoplaniny. Każdy z nich jest unikalny pod względem rodzajów interakcji molekularnych, które zapewnia, oraz liczby centrów chiralnych. Zapewniają one bardzo różną enancjoselektywność, ale wszystkie oferują korzyści wynikające z oddziaływań jonowych i zdolność do pracy w wodnych układach odwróconej fazy, polarnych jonowych i polarnych organicznych fazach ruchomych.
Jaka jest różnica między CHIROBIOTIC V i V2; T i T2?
Astec CHIROBIOTIC V i T różnią się odpowiednio od V2 i T2 chemią wiązania, która zapewnia im różną selektywność i zdolność preparatywną dla niektórych klas analitów.
Jakie są zalecane protokoły przesiewowe CHIROBIOTIC? Polarne jonowe (PIM) - metanol/kwas octowy/TEA (100:0,1:0,1 v/v/v). Optymalizacja poprzez zmianę stosunku kwasowo-zasadowego (do 1% każdego), zmianę rodzaju kwasu lub zasady lub dodanie lotnej soli (przetestuj różne sole amonowe).
Odwrócona faza (RP) - metanol lub acetonitryl/20 mM octan amonu, pH 5 (30:70). Optymalizacja poprzez zmianę % lub typu modyfikatora organicznego, dostosowanie pH, typu buforu, siły jonowej.
Polarne rozpuszczalniki organiczne (POM) - etanol. Optymalizacja poprzez użycie innych polarnych rozpuszczalników organicznych lub mieszanek.
Faza normalna (NP) - etanol/heptan (30:70). Optymalizacja poprzez zmianę % modyfikatora polarnego lub zmianę obu rozpuszczalników.
Jaki jest efekt różnych soli w PIM?
W polarnym trybie jonowym (PIM), DEA lub wodorotlenek amonu mogą zastąpić TEA, ale selektywność będzie inna
Jak wykorzystać stosunek kwasowo-zasadowy do regulacji enancjoselektywności i retencji?
CHIROBIOTIC CSP posiadają jonowe grupy funkcyjne i są idealne do stosowania w tak zwanym polarnym trybie jonowym, który definiuje się jako polarne rozpuszczalniki organiczne (metanol lub acetonitryl), do których dodaje się rozpuszczalne sole, kwasy, zasady lub kombinacje tych dodatków. Polarny tryb jonowy jest przydatny w przypadku jonizowalnych związków, gdzie dobrą początkową fazą ruchomą jest 0,1% TEA / 0,1% kwasu octowego w metanolu. W przypadku LC-MS należy stosować lotne sole amonowe, takie jak mrówczan amonu lub trifluorooctan amonu. Podczas pracy z polarnym trybem jonowym opracowanie i optymalizacja metody obejmuje dostosowanie stosunku kwasu (zazwyczaj kwasu octowego) do zasady (zazwyczaj TEA) w celu dostosowania selektywności i retencji. Stosunek ten zależy od pKa enancjomerów i innych czynników. W przypadku analitów zasadowych należy użyć większej proporcji kwasu, podczas gdy w przypadku analitów kwasowych należy użyć większej proporcji zasady. Stosunek kwasowo-zasadowy może wynosić od 4:1 do 1:4. Stosunek 1:1 jest używany do celów przesiewowych. Jeśli retencja jest nadal zbyt krótka, użycie niskiego stężenia TEAA (0,1%) lub zastąpienie metanolu do 50% acetonitrylem zmniejszy siłę fazy ruchomej. Jeśli jednak związek jest neutralny i niezbyt polarny, retencja w warunkach jonów polarnych będzie niewielka lub żadna i należy wypróbować inny system fazy ruchomej, taki jak faza normalna.
Kiedy zaleca się dodawanie wody do faz ruchomych w trybie jonów polarnych (PIM)?
Jonowe grupy funkcyjne obecne w fazach CHIROBIOTIC oznaczają, że można stosować dodatki polarne (sole, wodę) w celu poprawy opracowywania metod, odtwarzalności metod i wydajności kolumn. Podczas opracowywania metody dla jonizowalnych analitów (kwasy, zasady, zwitteriony) na kolumnach Astec CHIROBIOTIC, dobrym punktem wyjścia jest polarny tryb jonowy (PIM). Fazą ruchomą w trybie polarno-jonowym jest metanol zawierający 0,1% w/v mrówczanu amonu. W celu optymalizacji można zmieniać stosunek NH4OH:kwas mrówkowy lub wypróbować inne sole amonowe (np. trifluorooctan lub octan). W zastosowaniach LC-MS do fazy ruchomej można dodać niewielką ilość wody (3-5%), aby poprawić czułość i powtarzalność metody. Dodatek wody pomaga poprawić rozpuszczalność soli w metanolu.
Jak zoptymalizować separację chiralną dla LC/MS?
Dla separacji CHIROBIOTYCZNYCH w trybie PIM należy stosować lotne sole (np. octan amonu, mrówczan amonu, TFA amonu). W przypadku separacji CYCLOBOND w trybie POM należy zastąpić TEA wodorotlenkiem amonu, obniżając stężenie o 50-75%. W przypadku obu typów kolumn w trybie fazy odwróconej (RP) należy użyć octanu amonu lub mrówczanu amonu.
Jak mogę poprawić wytrzymałość i powtarzalność metody polarno-jonowej (PIM)?
Rozdzielanie enancjomerów polarnych i jonowych jest unikalną i cenną cechą Astec CHIROBIOTIC CSP. Fazy ruchome do tych separacji są dość proste: polarne rozpuszczalniki organiczne, takie jak metanol lub acetonitryl, zawierające lotne kwasy i zasady lub odpowiadające im sole. Stężenia kwasu i zasady lub stosunek kwasu do zasady są zmieniane w celu optymalizacji retencji i selektywności. Jednak zmienność czasu retencji i powolna równowaga mogą wystąpić, gdy dodatki te są stosowane w wysokich stężeniach lub gdy rozpuszczalność dodatku w rozpuszczalniku jest ograniczona. Stwierdziliśmy, że dodanie niewielkiej ilości wody do fazy ruchomej zwiększa rozpuszczalność dodatku, skraca czas wyrównania i w razie potrzeby poprawia stabilność czasów retencji. Zazwyczaj dodanie od 5 do 10% v/v wody do fazy ruchomej metanolu było wystarczające do zapewnienia stabilnej retencji i utrzymania enancjoselektywności, przy jednoczesnym zachowaniu tego samego mechanizmu jonowego.
Jak mogę ustabilizować retencję w separacjach w trybie jonów polarnych (PIM)? Dodanie 5% wody do metanolu/0,1% ATFA jest ważne w niektórych zastosowaniach PIM, jeśli czas retencji nie jest tak stabilny, jak powinien.
Jak odnowić kolumnę CHIROBIOTIC?
Jonowe grupy funkcyjne obecne w fazach CHIROBIOTIC oznaczają, że można stosować dodatki polarne (sole, woda) w celu poprawy rozwoju metody, odtwarzalności metody i wydajności kolumny. Aby utrzymać kolumny w najwyższej wydajności i zmaksymalizować żywotność i powtarzalność metody podczas pracy, kolumny Astec CHIROBIOTIC na bazie antybiotyków makrocyklicznych powinny być czyszczone raz w tygodniu za pomocą 20 objętości kolumny fazy ruchomej acetonitryl:50 mM octan amonu (50:50), a następnie 20 objętości kolumny 100% metanolu. Przed przechowywaniem kolumny zalecamy przeprowadzenie szybkiego testu QA z użyciem 5-metylo-5-fenylohydantoiny z metanolem jako fazą ruchomą. Szczegółowe informacje można znaleźć w raporcie z testu QA dołączonym do kolumny.
Jak ponownie przetestować kolumny CHIROBIOTIC?
Aby zapewnić selektywność kolumn CHIROBIOTIC, należy okresowo testować kolumnę z 5-metylo-5-fenylohydantoiną w 100% metanolowej fazie ruchomej.
Jaki jest najlepszy rozpuszczalnik do przechowywania kolumn CHIROBIOTIC?
Acetonitryl lub metanol są odpowiednie do krótkotrwałego przechowywania, do dłuższego przechowywania (>24 godziny) zalecany jest izopropanol.
Jak określić, która kolumna jest najlepsza do rozdzielania aminokwasów?
Większość aminokwasów jest chiralna, z formą L dominującą w przyrodzie. D-aminokwasy i stosunek form D do L są badane z różnych powodów, w tym w badaniach farmaceutycznych i w celu zbadania ich pozaziemskiego pochodzenia. Chiralne fazy stacjonarne HPLC i GC firmy Astec są wyjątkowo odpowiednie do separacji chiralnych aminokwasów, w tym natywnych aminokwasów i ich N-blokowanych pochodnych. CHIROBIOTYCZNE CSP mają jonowe grupy funkcyjne i dlatego umożliwiają chiralną dyskryminację związków z grupami jonowymi lub jonizowalnymi. Działają one również w fazach ruchomych, które są kompatybilne z MS i w których aminokwasy są swobodnie rozpuszczalne. Inne fazy, w szczególności Astec CLC i różne chemikalia CYCLBOND, również znalazły zastosowanie w separacji enancjomerów aminokwasów. Ogólne wytyczne dotyczące wyboru HPLC CSP do separacji chiralnych aminokwasów można znaleźć w naszym drzewie decyzyjnym.

Astec CYCLOBOND Chiral HPLC
Czym jest CYCLOBOND?
Wszechstronne i unikalne CSP Astec CYCLOBOND™ (chiralne fazy stacjonarne) to rodzina pochodnych i niedostatecznie aktywowanych β- i γ-cyklodekstryn związanych z żelem krzemionkowym o wysokiej czystości. Wynalezione przez profesora Daniela W. Armstronga i wprowadzone na rynek w 1984 roku, znalazły szerokie zastosowanie w separacji izomerów metodą HPLC, zarówno chiralnych, jak i achiralnych. Astec CYCLOBOND jest komplementarny do innych CSP, w tym CSP opartych na polisacharydach, CSP Astec CHIROBIOTIC® opartych na makrocyklicznych glikopeptydach oraz CSP Astec P-CAP™ i Astec P-CAP-DP opartych na kopolimerach aminowych.
Czym są cyklodekstryny?
Cykodekstryny są wytwarzane w wyniku częściowej degradacji skrobi, a następnie enzymatycznego łączenia jednostek glukozy w krystaliczne, jednorodne struktury toroidalne o różnej wielkości cząsteczkowej. Reszty D(+)-glukozy są połączone ze sobą wiązaniami a-(1,4)glikozydowymi. Krzesełkowa konfiguracja reszt glukozy sprawia, że toroid jest węższy na jednym końcu. Trzy wysoko scharakteryzowane cyklodekstryny to cyklodekstryny alfa (α), beta (ß) i gamma (γ), które zawierają odpowiednio sześć, siedem i osiem jednostek glukozy. Ponieważ każda reszta glukozy ma pięć centrów chiralnych, cyklodekstryny same w sobie są strukturami chiralnymi. Na przykład ß-cyklodekstryna ma 35 centrów chiralnych.
W jaki sposób CSP oparte na cyklodekstrynach (w tym CYCLOBOND) oddzielają enancjomery?
Zarówno architektura, jak i chemia cyklodekstryn przyczyniają się do separacji enancjomerów. Toroidalna struktura cyklodekstryny ma hydrofilową powierzchnię zewnętrzną wynikającą z 2-, 3- i 6-pozycyjnych grup hydroksylowych (OH). Wewnętrzna wnęka cyklodekstryny składa się z oksygenów glukozy i wodorów metylenowych, co nadaje jej niepolarny (hydrofobowy) charakter. Oddziaływania chemiczne prowadzące do separacji chiralnej zachodzą zarówno na zewnętrznej, jak i wewnętrznej powierzchni toroidu cyklodekstryny. Najważniejszym czynnikiem wpływającym na retencję i rozpoznawanie chiralne jest odpowiednie dopasowanie analitu do wnęki cyklodekstryny. Dopasowanie to jest funkcją zarówno wielkości cząsteczki, jak i kształtu analitu względem wnęki cyklodekstryny. Istnieją zatem dwa podstawowe mechanizmy w separacji chiralnej na cyklodekstrynach: te, które występują na wewnętrznej powierzchni wnęki (kompleksowanie inkluzyjne) i te, które występują na zewnętrznej powierzchni (interakcje powierzchniowe) toroidu cyklodekstryny.
Co to jest "kompleksowanie inkluzyjne"?
Podstawą wielu separacji na CSP opartych na cyklodekstrynach w trybie fazy odwróconej (fazy ruchome zawierające wodę z metanolem lub acetonitrylem) jest zjawisko zwane kompleksowaniem inkluzyjnym. Jeśli analit może zmieścić się we wnęce cyklodekstryny, a warunki fazy ruchomej są korzystne, może wystąpić mechanizm kompleksowania inkluzyjnego. To właśnie z powodu kompleksowania inkluzyjnego faza odwrócona jest bardzo skutecznym trybem dla CSP CYCLOBOND. Do rozróżnienia chiralnego wymagane są trzy punkty interakcji, a kompleksowanie inkluzyjne zapewnia jedną z trzech interakcji. Mechanizm kompleksowania inkluzyjnego przypisuje się przyciąganiu apolarnej cząsteczki lub segmentu cząsteczki do apolarnej wnęki cyklodekstryny, która jest bardzo wrażliwa na różnice strukturalne. Gdy analit posiada grupę aromatyczną, orientacja we wnęce jest selektywna ze względu na współdzielenie elektronów między aromatycznymi grupami metylenowymi i oksygenami glukozydowymi na wewnętrznej powierzchni toroidu cyklodekstryny. Mechanizm ten jest uzupełniany przez oddziaływanie rozpuszczonych grup funkcyjnych z 2- i 3-pozycyjnymi drugorzędowymi grupami hydroksylowymi pierścienia cyklodekstryny.
Co sprawia, że CSP Astec CYCLOBOND są wyjątkowe?
CSP CYCLOBOND oferują wyjątkową selektywność chiralną dzięki wielu mechanizmom chiralnym zapewnianym przez wnękę cyklodekstryny i grupy funkcyjne różnych pochodnych. CYCLOBOND CSP charakteryzują się stabilnością chemiczną zapewniającą długą żywotność, szeroki wybór faz ruchomych i wysoką wydajność.
Jakie rodzaje enancjomerów są rozdzielane na CYCLOBOND CSP firmy Astec?
Ogólnie rzecz biorąc, podstawione pierścienie fenylowe, naftylowe i bifenylowe mogą być rozdzielane na CYCLOBOND I 2000 na bazie ß-cyklodekstryny i jej pochodnych. Cząsteczki z pierścieniami heterocyklicznymi również często rozdzielają się na tych fazach. Anality z trzema do pięciu pierścieniami, w tym steroidy, najlepiej rozdzielają się na CYCLOBOND II na bazie g-cyklodekstryny i jego pochodnych. Enancjomery z halogenami, azotanami, siarczanami, fosforanami i hydroksylami na pierścieniach aromatycznych analitu generalnie dobrze rozdzielają się na CYCLOBOND CSP. CYCLOBOND z powodzeniem rozdziela również związki z grupami funkcyjnymi wiążącymi wodór poza pierścieniem, izomery cis/trans i pozycyjne blisko spokrewnione cząsteczki achiralne oraz pochodne chiralne aminokwasy.
Jakie są zalecane protokoły badań przesiewowych CYCLOBOND?
Faza odwrócona (RP) - acetonitryl/20 mM octan amonu, pH 5 (30:70) lub metanol/20 mM octan amonu, pH 5 (20:80). Optymalizacja poprzez zmianę % lub typu modyfikatora organicznego, dostosowanie pH, typu buforu, siły jonowej.
Polarne organiczne (POM) - acetonitryl/metanol/kwas octowy/TEA (95:5:0,1:0,1). Optymalizacja przy użyciu innych polarnych rozpuszczalników organicznych lub mieszanek. Zmień stosunek kwasowo-zasadowy (do 1% każdego z nich). Należy zauważyć, że metanol i acetonitryl wykazują duże różnice w CYCLOBOND w trybie POM.
Faza normalna (NP) - etanol/heptan (30:70). Optymalizacja poprzez zmianę % modyfikatora polarnego lub zmianę obu rozpuszczalników.
Jak odnowić kolumnę CYCLOBOND?
Przepłukać kolumny 10 objętościami etanolu, a następnie wodą klasy HPLC. Następnie przepłukać kolumnę 10 objętościami acetonitrylu przy niskim natężeniu przepływu. Etanol jest dwa razy bardziej skuteczny w wypieraniu substancji z wnęki niż metanol.
Jaki jest najlepszy rozpuszczalnik do przechowywania kolumn CYCLOBOND?
Acetonitryl jest odpowiedni do krótkotrwałego przechowywania, do dłuższego przechowywania (24 godziny) zalecany jest izopropanol.
Jak mogę ponownie przetestować kolumny CYCLOBOND?
Odnieś się do raportu QA kolumny, zapoznaj się z instrukcjami dla CYCLOBOND lub skontaktuj się z Usługami technicznymi w celu uzyskania procedury testowej.
Preparatywna chiralna HPLC
Co z izolacjami preparatywnymi na chiralnych kolumnach HPLC Astec?
Znaczącą zaletą Astec CHIROBIOTIC w zastosowaniach preparatywnych jest fakt, że faza ruchoma może być dobrana tak, aby zoptymalizować rozpuszczalność próbki - krytyczny czynnik w zastosowaniach preparatywnych. Kolumny Astec CHIROBIOTIC mogą być stosowane we wszystkich preparatywnych technikach HPLC, w tym w chromatografii elucyjnej i recyrkulacyjnej, przygotowaniu ukierunkowanym na masę, SFC i symulowanym ruchomym złożu (SMB). Skalowanie jest wysoce przewidywalne, ponieważ ta sama chemia fazy związanej jest stosowana we wszystkich rozmiarach cząstek. Wielokrotne wiązania kowalencyjne przyłączają makrocykliczne glikopeptydy Astec CHIROBIOTIC do powierzchni krzemionki, co oznacza, że żaden ligand CSP nie zanieczyści produktu. Separacje preparatywne na kolumnach Astec CHIROBIOTIC często charakteryzują się większą szybkością i wydajnością w porównaniu z innymi kolumnami CSP. Jeśli chodzi o pojemność ładunkową, kolumna 25 cm x 21,2 mm ma średnią lub wysoką pojemność ładunkową, od kilku mg do ponad 300 mg na wstrzyknięcie. Separacje preparatywne na Astec CHIROBIOTIC są powtarzalne i skalowalne.
Co to jest SMB do preparatyki?
SMB (symulowane ruchome złoże) to forma chromatografii preparatywnej, która wykorzystuje wiele kolumn, które działają wspólnie jako pojedyncza kolumna. Wydajność przy użyciu SMB może być znacznie wyższa niż w przypadku formatu wsadowego lub kolumnowego. Cechy Astec CHIROBIOTIC CSP, które sprawiają, że są one idealne do przygotowania, w tym SMB, to doskonała enancjoselektywność, szczególnie w przypadku związków polarnych i jonowych, elastyczność fazy ruchomej w celu zmaksymalizowania rozpuszczalności próbki, wszechstronność do pracy we wszystkich fazach ruchomych bez efektów pamięci i wysoka wydajność kolumny zapewniająca wysoką przepustowość i minimalne przetwarzanie końcowe. Wytrzymałość kolumn CSP CHIROBIOTIC, szczególnie istotna w przypadku przygotowania przez SMB, umożliwia długotrwałą i niezawodną pracę. Nowe kolumny Astec CHIROBIOTIC dla SMB charakteryzują się wielkością cząstek i wymiarami kolumn dobranymi pod kątem wysokiego natężenia przepływu i wysokiej wydajności. Zestaw 8 kolumn ma wydajność dopasowaną z dokładnością do 6% rsd. Pojedyncze kolumny o wymiarach 25 cm x 4,6 mm I.D. i 5 cm x 10 mm I.D. są dostępne do opracowywania metod i eksperymentów skalowania.
Porady i wskazówki dotyczące chiralnej HPLC
Czy w chiralnej HPLC należy brać pod uwagę szybkość przepływu?
Ponieważ większość chiralnych faz stacjonarnych jest bardzo złożona (gęsto związane, duże cząsteczki), cierpią one z powodu wysokiego członu C w równaniu van Deemtera. Jest to wysoka odporność na przenoszenie masy przez fazę stacjonarną. Dlatego powyżej optymalnego natężenia przepływu wydajność spada bardzo szybko. W przypadku separacji krytycznych, w których enancjomery nie są dobrze rozdzielone, warto zbadać wpływ szybkości przepływu na rozdzielczość separacji. Badania Van Deemtera przeprowadzone na kolumnach CHIROBIOTIC T i V2 o średnicy wewnętrznej 4,6 mm i cząstkach 5 µm w trybie fazy odwróconej, polarno-jonowym i polarno-organicznym wykazały, że największą wydajność szczytową uzyskuje się przy szybkościach przepływu od 0,15 do 0,2 ml/min. (prędkości liniowe między 0,2 a 0,3 mm/s; zmniejszone prędkości liniowe między 0,61 a 0,81). W związku z tym zmniejszenie szybkości przepływu poza normę może zwiększyć wydajność każdego piku, a tym samym poprawić rozdzielczość enancjomerów. Po osiągnięciu selektywności enancjomerycznej na chiralnej fazie stacjonarnej, rozdzielczość enancjomerów można poprawić poprzez zmianę składu fazy ruchomej, temperatury i/lub natężenia przepływu. Szybkość przepływu 1,0 ml/min. jest często stosowana podczas opracowywania metody na kolumnach o średnicy wewnętrznej 4,6 mm wypełnionych cząstkami o wielkości 5 µm. W celu optymalizacji metody, jeśli enancjomery są rozdzielane, ale nie są w pełni rozdzielane przy 1 ml/min, zmniejszenie przepływu poniżej 1,0 ml/min może dodatkowo zwiększyć rozdzielczość.
Jaki jest wpływ temperatury w chiralnej HPLC? Temperaturę można wykorzystać do zmiany enancjoselektywności separacji na chiralnych fazach stacjonarnych. Rola temperatury jest bardzo złożoną zależnością termodynamiczną między interakcjami rozpuszczalnik/faza ruchoma/CSP. Zmiana temperatury spowoduje zmianę termodynamicznego zachowania substancji rozpuszczonych wynikającego z wyżej wymienionych oddziaływań. Czasami zwiększenie temperatury poprawia rozdzielczość, a czasami jej obniżenie daje pożądaną poprawę. Zjawisko to jest nieprzewidywalne, więc temperatura daje chromatografom kolejne narzędzie do optymalizacji.
Jak zmierzyć objętość pustej przestrzeni w chiralnej kolumnie HPLC?
Z powodu wielu różnych rodzajów interakcji możliwych z większością chiralnych faz stacjonarnych, dość trudno jest znaleźć całkowicie niezatrzymany związek. W przypadku kolumny HPLC wypełnionej tradycyjnymi porowatymi kulistymi cząstkami krzemionki, przybliżona objętość pustej przestrzeni wynosi około 70% objętości kolumny (0,7πr2L). Dla kolumny 25 cm x 4,6 mm byłoby to około 3 ml. Przy prędkości 1 mL/min. dałoby to T0 3 min. przy 1 mL/min.
Czy mogę użyć elucji gradientowej w chiralnej HPLC i kiedy powinienem ją wypróbować?
Fazy HPLC, w których chiralny ligand jest kowalencyjnie związany z powierzchnią cząstek, takie jak Astec CHIROBIOTIC, Astec CYCLOBOND oraz Astec P-CAP i P-CAP-DP, są w pełni kompatybilne z elucją gradientową. Ale kiedy można zastosować elucję gradientową w chiralnej HPLC? Po pierwsze, gradienty można wykorzystać do przyspieszenia procesu przesiewania za pomocą bardziej ogólnej metody, która obejmowałaby szerszy zakres typów próbek. Selektywność wykrywana za pomocą gradientów może być następnie zoptymalizowana do izokratycznej. Astec CHIROBIOTIC i większość faz CYCLOBOND, które działają w trybie fazy odwróconej i mogą wykorzystywać typowe gradienty typu RP (zwiększanie siły rozpuszczalnika poprzez zwiększanie % modyfikatora organicznego). Dodatkowo, ze względu na jonowy charakter Astec CHIROBIOTIC, reagują one również na zwiększenie siły jonowej (zwiększenie % dodatku rozpuszczalnej soli, np. octanu amonu, 0 - 0,2%). Drugim powodem stosowania gradientów jest utrzymanie czystych, niezanieczyszczonych kolumn, gdy wstrzykiwane są zanieczyszczone próbki. Gradienty mogą być stosowane w celu usunięcia silnie związanych składników matrycy z kolumn. (Należy zwrócić uwagę na proces regeneracji/kondycjonowania faz CHIROBIOTIC w celu przywrócenia charakteru jonowego zalecany w FAQ: "How do I recondition my CHIROBIOTIC column?". Aby uzyskać więcej informacji na temat tego, czy elucja gradientowa byłaby odpowiednia dla Twoich próbek i systemu, skonsultuj się z naszymi usługami technicznymi.
Jak zalecacie konwersję instrumentów z fazy normalnej (NP) na fazę odwróconą (RP) i z powrotem?
Najlepszym rozwiązaniem jest posiadanie dedykowanego instrumentu do każdego trybu. Uszczelki ulegają znacznemu zużyciu w wyniku rozszerzania/kurczenia. Jeśli jednak nie masz takiej możliwości, oto kilka rzeczy, które uznaliśmy za ważne:
(1) Naszą regularną praktyką jest intensywne płukanie IPA przed przejściem na wodę. Podczas całego płukania należy pamiętać o uwzględnieniu całej ścieżki płynu (pompa, autosampler, detektor).
(2) Jeśli chodzi o autosampler, należy pamiętać o uwzględnieniu pętli próbki i wszelkich innych ścieżek płynu, które występują podczas normalnej pracy podczas wykonywania wstrzyknięć - może się to znacznie różnić w zależności od tego, czy autosampler jest konstrukcją z pętlą zewnętrzną, czy z pętlą wewnętrzną.
(3) W ramach wszystkich płukań upewnij się, że igła wtryskowa również została umyta - może wykonaj kilka pełnych wstrzyknięć rozpuszczalnika (oczywiście bez kolumny).
(4) Dobrym pomysłem może być również przepłukanie metanolem (lub etanolem) po IPA przed przejściem do wody. Metanol pomoże wypłukać IPA szybciej niż bezpośrednie przejście z IPA do wody. Wszystko to oczywiście przy założeniu, że IPA jest mieszalny z najsłabszym rozpuszczalnikiem NP, na który system był narażony.
(5) Tak więc przejście w drugą stronę (RP-> NP) jest po prostu odwrotne.
Konwersja RP na NP i odwrotnie (bardzo ważne, aby dodać kilka zakazów do dos):
- Usuń wszystkie dodatki i zacznij od 100% izopropanolu we wszystkich zbiornikach.
- Izopropanol jest w pełni mieszalny ze wszystkimi popularnymi rozpuszczalnikami i jest najbezpieczniejszym rozpuszczalnikiem do zmiany w obu kierunkach.
- Używaj niskiego przepływu - około połowy normalnego, aby uniknąć możliwego uszkodzenia kolumny z powodu nadmiernego ciśnienia.
- Nie używaj acetonitrylu rutynowo jako organicznego - jest lepszy niż metanol, ale nie jest w pełni mieszalny z czystymi węglowodorami.
- Nie używaj metanolu rutynowo jako organicznego - nie jest w pełni mieszalny z wieloma normalnymi warunkami fazowymi.
- Zarówno acetonitryl, jak i metanol mogą być używane do rutynowej zmiany z RP na HILIC (NP polarnych substancji rozpuszczonych przy użyciu polarnych wodnych faz ruchomych) i z powrotem.
- Przed rozpoczęciem należy sprawdzić mieszalność (użyć małego zewnętrznego naczynia) z docelową fazą ruchomą, zwłaszcza jeśli nie wybrano izopropanolu.
- W przypadku zmiany aparatu gradientowego należy użyć organicznych środków we wszystkich liniach, aby upewnić się, że woda lub węglowodory zostały usunięte ze wszystkich obszarów cieczy.
- Podczas zmiany należy monitorować sygnały ciśnienia i detektora, co stanowi doskonałą metodę potwierdzenia pełnej równowagi systemu.
- Niekompletne mieszanie objawia się silnym szumem linii bazowej detektora lub wahaniami ciśnienia (kulki niemieszającego się rozpuszczalnika przypominają pęcherzyki).
- Przepłucz detektory i wszystkie inne komponenty, nawet jeśli linia bazowa nie jest monitorowana.
- Sprawdź gradientowe ślepe przebiegi pod kątem szumu linii bazowej, który może wskazywać na kieszenie niemieszającego się rozpuszczalnika.
- Dobra chromatografia jest ostatecznym testem - najpierw użyj prostych standardowych mieszanin testowych i pracuj nad prawdziwymi próbkami.
- Całkowity czas przełączenia może się różnić, ale powinien zająć około godziny - pośpiech zwykle spowalnia proces.
- Nie oczekuj szybkiego przełączenia z detektorami współczynnika załamania światła - są one bardzo powolne do wyrównania po przełączeniu.
Jakie są wskazówki dotyczące chiralnej analizy śladowej?
Użycie 5% 20mM fosforanu amonu (pH 3,1)/95% metanolu może być bardzo przydatne do analizy śladowej i dla związków zawierających zarówno COOH, jak i NH w pobliżu C*. Należy również wziąć pod uwagę kolejność elucji. Enancjomer w śladowych ilościach powinien eluować jako pierwszy. Rozważ również wąskie kolumny I.D. (2,1 mm lub 1 mm). Wszystko, co zwiększy wydajność, zwiększy również czułość. Ogólnie rzecz biorąc, największą dźwignią jest natężenie przepływu: upewnij się, że pracujesz z optymalnym natężeniem przepływu dla wymiaru kolumny. W chiralnej HPLC optymalne natężenie przepływu może być bardzo wolne.
Jak zoptymalizować separację chiralną dla LC/MS?
Dla separacji CHIROBIOTYCZNYCH w trybie PIM należy stosować lotne sole (np. octan amonu, mrówczan amonu, amonowy TFA). W przypadku separacji CYCLOBOND w trybie POM należy zastąpić TEA wodorotlenkiem amonu, obniżając stężenie o 50-75%. W przypadku obu typów kolumn w trybie fazy odwróconej (RP) należy użyć octanu amonu lub mrówczanu amonu.
Jak mogę usunąć zakłócenia fosfolipidowe w bioanalitycznym chiralnym LC-MS?
Kolumny Astec CHIROBIOTIC mogą być używane w połączeniu z płytkami HybridSPE™-PPT w celu zwiększenia czułości poprzez całkowite usunięcie endogennych białek i fosfolipidów.
Jak przygotować bufor TEAA?
0,1% roztwór TEAA (octan trietyloaminy) jest często stosowany w fazach ruchomych odwróconych (RP) i polarnym trybie jonowym (PIM). W przypadku RP należy dodać TEA v/v do wody i miareczkować do żądanego pH kwasem octowym. W przypadku faz ruchomych PIM używamy 100/0,1/0,1, metanol/kwas octowy/TEA (v/v/v), który jest wytwarzany przez dodanie 1 ml TEA i 1 ml kwasu octowego do 1 l metanolu.
Jak ustabilizować czasy retencji w trybie polarno-jonowym (PIM)?
Dodanie 5% wody do metanolu/0.1% ATFA jest ważne w niektórych zastosowaniach PIM, jeśli czas retencji nie jest tak stabilny, jak powinien
Jak mogę poprawić wytrzymałość i powtarzalność metody polarno-jonowej (PIM)?
Rozdzielanie enancjomerów polarnych i jonowych jest unikalną i cenną cechą Astec CHIROBIOTIC CSP. Fazy ruchome do tych separacji są dość proste: polarne rozpuszczalniki organiczne, takie jak metanol lub acetonitryl, zawierające lotne kwasy i zasady lub odpowiadające im sole. Stężenia kwasu i zasady lub stosunek kwasu do zasady są zmieniane w celu optymalizacji retencji i selektywności. Jednak zmienność czasu retencji i powolna równowaga mogą wystąpić, gdy dodatki te są stosowane w wysokich stężeniach lub gdy rozpuszczalność dodatku w rozpuszczalniku jest ograniczona. Stwierdziliśmy, że dodanie niewielkiej ilości wody do fazy ruchomej zwiększa rozpuszczalność dodatku, skraca czas wyrównania i w razie potrzeby poprawia stabilność czasów retencji. Zazwyczaj dodanie od 5 do 10% v/v wody do fazy ruchomej metanolu było wystarczające do zapewnienia stabilnej retencji i utrzymania enancjoselektywności, przy jednoczesnym zachowaniu tego samego mechanizmu jonowego.
Jak mogę ustabilizować retencję w separacjach w trybie jonów polarnych (PIM)? Dodanie 5% wody do metanolu/0,1% ATFA jest ważne w niektórych zastosowaniach PIM, jeśli czas retencji nie jest tak stabilny, jak powinien.
Jak wykorzystać stosunek kwasowo-zasadowy do regulacji enancjoselektywności i retencji?
CHIROBIOTIC CSP posiadają jonowe grupy funkcyjne i są idealne do stosowania w tak zwanym polarnym trybie jonowym, który definiuje się jako polarne rozpuszczalniki organiczne (metanol lub acetonitryl), do których dodaje się rozpuszczalne sole, kwasy, zasady lub kombinacje tych dodatków. Polarny tryb jonowy jest przydatny w przypadku jonizowalnych związków, gdzie dobrą początkową fazą ruchomą jest 0,1% TEA / 0,1% kwasu octowego w metanolu. W przypadku LC-MS należy stosować lotne sole amonowe, takie jak mrówczan amonu lub trifluorooctan amonu. Podczas pracy z polarnym trybem jonowym opracowanie i optymalizacja metody obejmuje dostosowanie stosunku kwasu (zazwyczaj kwasu octowego) do zasady (zazwyczaj TEA) w celu dostosowania selektywności i retencji. Stosunek ten zależy od pKa enancjomerów i innych czynników. W przypadku analitów zasadowych należy użyć większej proporcji kwasu, podczas gdy w przypadku analitów kwasowych należy użyć większej proporcji zasady. Stosunek kwasowo-zasadowy może wynosić od 4:1 do 1:4. Stosunek 1:1 jest używany do celów przesiewowych. Jeśli retencja jest nadal zbyt krótka, użycie niskiego stężenia TEAA (0,1%) lub zastąpienie metanolu do 50% acetonitrylem zmniejszy siłę fazy ruchomej. Jeśli jednak związek jest neutralny i niezbyt polarny, retencja w warunkach jonów polarnych będzie niewielka lub żadna i należy wypróbować inny system fazy ruchomej, taki jak faza normalna.
Kiedy zaleca się dodawanie wody do faz ruchomych w trybie jonów polarnych (PIM)?
Jonowe grupy funkcyjne obecne w fazach CHIROBIOTIC oznaczają, że można stosować dodatki polarne (sole, woda) w celu poprawy rozwoju metody, odtwarzalności metody i wydajności kolumny. Podczas opracowywania metody dla jonizowalnych analitów (kwasy, zasady, zwitteriony) na kolumnach Astec CHIROBIOTIC, dobrym punktem wyjścia jest polarny tryb jonowy (PIM). Fazą ruchomą w trybie polarno-jonowym jest metanol zawierający 0,1% w/v mrówczanu amonu. W celu optymalizacji można zmieniać stosunek NH4OH:kwas mrówkowy lub wypróbować inne sole amonowe (np. trifluorooctan lub octan). W zastosowaniach LC-MS do fazy ruchomej można dodać niewielką ilość wody (3-5%), aby poprawić czułość i powtarzalność metody. Dodatek wody pomaga poprawić rozpuszczalność soli w metanolu.
Chiralna GC
Czym są cyklodekstryny?
Cyklodekstryny są wytwarzane przez częściową degradację skrobi, a następnie enzymatyczne łączenie jednostek glukozy w krystaliczne, jednorodne struktury toroidalne o różnej wielkości cząsteczkowej. Reszty D(+)-glukozy są połączone ze sobą wiązaniami α-(1,4)glikozydowymi. Krzesełkowa konfiguracja reszt glukozy sprawia, że toroid jest węższy na jednym końcu. Trzy wysoko scharakteryzowane cyklodekstryny to cyklodekstryny alfa (α), beta (ß) i gamma (γ), które zawierają odpowiednio sześć, siedem i osiem jednostek glukozy. Ponieważ każda reszta glukozy ma pięć centrów chiralnych, cyklodekstryny same w sobie są strukturami chiralnymi. Na przykład ß-cyklodekstryna ma 35 centrów chiralnych.
Co odróżnia waszą linię chiralnych GC od konkurencji?
Kompletność i zakres. Oferujemy konwencjonalne fazy permetylowane, ale także fazy polarne (np. Supelco DEX 225 i kilka faz CHIRALDEX). Ponadto oferujemy 24 różne składy chemiczne w wielu rozmiarach kolumn.
Jakie chiralne kolumny GC powinienem mieć w moim protokole przesiewowym?
Na podstawie naszego doświadczenia w wykorzystywaniu różnic selektywności między liniami CHIRALDEX i Supelco DEX, zalecamy następujące kolumny do uwzględnienia w kompleksowym protokole przesiewowym GC:
1. Supelco ß-DEX 110 (Permethyl, 2,3,6-tri-O-methyl)
ß-DEX 110 jest fazą permetylowaną. Jest szczególnie skuteczna w przypadku nasyconych analitów o minimalnej funkcjonalności, nasyconych cyklicznych i nasyconych bicyklicznych.
2. Astec CHIRALDEX G-TA (trifluoroacetyl, 2,6-di-O-pentyl-3-trifluoroacetyl)
G-TA rozdziela największą liczbę enancjomerów, często z wysoką enancjoselektywnością.
3. Astec CHIRALDEX B-DA (dialkil, 2,6-di-O-pentylo-3-metoksy)
B-DA najlepiej nadaje się do większych struktur wielopierścieniowych. Często wykazuje enancjorewersję separacji wykonanych w fazie 110 (permetylowanej).
4. Astec CHIRALDEX B-DM (Dimethyl, 2,3-di-O-methyl-6-t-butyl silyl)
B-DM rozdziela najszerszą gamę różnych typów strukturalnych.
5. Astec CHIRALDEX G-PN (propionyl, 2,6-di-O-pentylo-3-propionyl)
G-PN działa jak G-TA, ale wykazuje wyższą selektywność wobec niektórych amin (amfetamina, metamfetamina), laktonów i epoksydów.
6. Astec CHIRALDEX B-PH (eter hydroksypropylowy, (S)-2-hydroksypropylometylowy)
G-PH jest szczególnie skuteczny w przypadku nasyconych analitów o minimalnej funkcjonalności, nasyconych cyklicznych i nasyconych bicyklicznych. Faza ta często wykazuje odwrócenie kolejności elucji (enancjorewersję) w porównaniu do fazy B-DA.
Derywatyzacja w chiralnej GC: Dlaczego jest konieczna i jakie rodzaje pochodnych wybrać dla jakich analitów?
Pochodne są potrzebne w GC, gdy niedowartościowane związki są niestabilne termicznie lub nie są wystarczająco lotne, aby mogły być przenoszone przez przepływ gazu. Niektóre związki wymagają derywatyzacji w celu uzyskania dobrego kształtu piku. Bezwodnik trifluorooctowy jest stosowany do alkoholi i amin, a także BSA i BSTFA do tych grup funkcyjnych. W przypadku kwasów najlepszym rozwiązaniem wydaje się być metanolowy HCl, można też użyć chloroformianu etylu. Nadal warto najpierw wypróbować niedowirowaną próbkę na kolumnach, aby sprawdzić, czy może działać, a także mieć porównanie.
Jak wybrać między fazami metylowanymi Supelco Dex i Astec?
Wszystkie nasze chiralne kolumny GC mają różną selektywność, nie pokrywają się bezpośrednio. Nasze permetylowane (wszystkie dostępne grupy hydroksylowe są metylowane) fazy to Supelco α-DEX, ß-DEX i ß-DEX 110 i 120 oraz CHIRALDEX B-PM. Posiadamy również fazy dimetylowane (Supelco α-DEX, ß-DEX i γ-DEX 325) oraz CHIRALDEX B-DM. Fazy Supelco DEX są tańsze, jeśli cena ma znaczenie.
Na rynku dostępnych jest wiele "permetylowanych" faz cyklodekstrynowych do chiralnej GC. Jakie są między nimi różnice?
Permetylacja oznacza po prostu, że wszystkie dostępne grupy -OH na cząsteczce CD zostały zmetylowane. Poza tym fazy mogą różnić się stężeniem derywatyzowanego CD w nośniku (jeśli nośnik jest w ogóle używany), rodzajem nośnika (polisiloksan), grubością warstwy, średnicą rurki kapilarnej, metodą dezaktywacji ścianki kapilary. Wszystkie chiralne fazy GC różnią się selektywnością, nawet jeśli mają ten sam rodzaj chemii fazowej.
Jak wybrać chiralną kolumnę GC w oparciu o grupy funkcyjne związku? Linie Astec CHIRALDEX i Supelco DEX obejmują najszerszy dostępny obecnie zakres derywatyzowanych faz cyklodekstrynowych (CD) do chiralnych separacji GC. 26 różnych faz obejmuje trzy różne cyklodekstryny i dziewięć różnych pochodnych. Fazy są pogrupowane w trzy ogólne kategorie w oparciu o pochodną i rodzaje interakcji, którym mają podlegać z analitami. Aby uzyskać ogólne wytyczne dotyczące wyboru chiralnej fazy GC w oparciu o grupę funkcyjną analitu, zapoznaj się z naszą tabelą kapilarnych kolumn GC z cyklodekstryną (poniżej). Skontaktuj się z naszym działem usług technicznych, jeśli potrzebujesz pomocy w podjęciu decyzji, która CSP GC jest najlepsza dla Twojej separacji.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?