의약품 이차표준품
머크의 이차표준품은 USP, EP, BP 일차표준품에 대한 다각적 측정소급성을 갖추고 있으며, ISO/IEC 17025 및 ISO 가이드 17034에 따라 제조되었습니다.
미국 식품의약국(FDA)과 유럽 약전(EP)은 해당하는 일차표준품을 참조하여 확립된 이차표준품 또는 상용표준품의 사용을 인증합니다. 자세한 내용은 이차표준품의 규제적 인증을 참조하세요.
특징 및 장점
제품의 주요 특징은 다음과 같습니다.
- 미국 약전(USP), 유럽 약전(EP), 영국 약전(BP)에 대한 측정소급성 제공(가능한 경우)
- 약전 시험법(Pharmacopeia monograph method)을 적용한 우수 의약품 제조 및 품질관리 기준(GMP)에 따라 밸리데이션을 시행
- 질량 균형 접근법(mass balance approach)을 사용하여 ISO 가이드 17034 및 ISO 17025에 따라 인증된 값
- ISO 가이드 31에 따른 포괄적인 분석성적서
주요 장점은 다음과 같습니다.
- 내부이차표준품(in-house working standard)을 직접 준비하고 특성 분석을 해야 하는 수고와 시간을 절약
포괄적인 분석성적서
분석성적서의 값은 현재의 약전 로트에서 항시 추적할 수 있습니다.
참고: 약전에 의해 새로운 일차표준품 로트가 생성되면 즉시 이차표준품 재인증 진행 후, 새로운 분석성적서를 온라인에서 사용할 수 있게 됩니다.
따라서, 물질을 사용하기 전에 항상 웹사이트에서 분석성적서를 다운로드해야 합니다!
분석성적서에 포함되는 데이터는 다음과 같습니다.
- 측정소급성 분석 결과와 약전 일차표준품의 비교
- 질량 균형 접근법을 사용한 ISO 17025에 따른 인증된 순도 값
- 취급 및 보관 지침
- 분석 데이터
아래 이미지에서 분석성적서 발췌본을 확인할 수 있으며, 일부 주요 정보가 강조되어 있습니다.
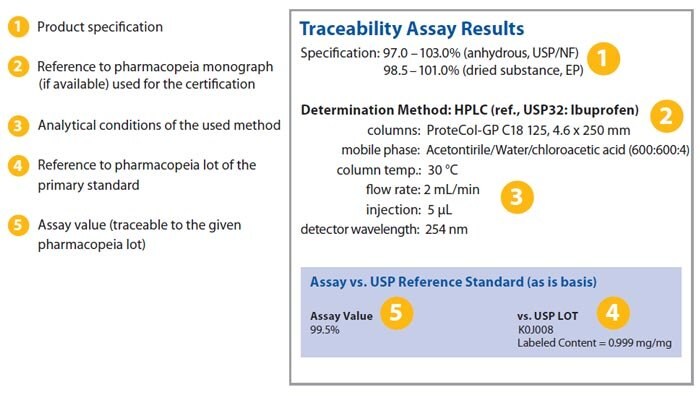
월별 의약품 이차표준품 COA 업데이트:
재인증 등으로 인해 COA가 변경되는 경우 해당 내용이 고객에게 사전 통지됩니다.
사용자는 이 서비스를 통해 항상 최신 버전의 분석성적서를 보유할 수 있습니다.
이차표준품의 규제적 인증
(1) 인체용 의약품 CGMP 참고 사항, 9부, 3호, 2001(FDA 내부 간행물):
Q: 기업이 미국 약전이 아닌 다른 출처의 표준품을 사용할 수 있나요?
A: 예. 표준품에 특유의 중요한 속성이 포함되어 있고, 의도한 목적에 적합하며, 완전한 문서 형태로 지원되는 경우 미국 약전 외에 다른 출처를 사용하는 것이 허용될 수 있습니다. 공급업체의 분석성적서는 전체적인 품질 특성 범위에 걸쳐 물질을 적절하게 분석할 수 있도록 시험 결과를 보고해야 합니다.
(2) FDA: 산업지침, 분석 절차와 시험법 밸리데이션, 2000년 8월:
"표준품(즉, 일차표준품)은 미국 약전(USP/NF)이나 기타 공식 출처(예: CBER, 21 CFR 610.0)에서 확인할 수 있습니다. 상용표준품(즉, 자사 또는 이차표준품)은 일차표준품을 대신하여 자격을 갖추고 사용되는 표준품입니다."
(3) 유럽 약전 5.12장:
"이차표준품은 일차표준품과 비교하여 확립한 표준품입니다. 이차표준품은 일차표준품과 비교하여 확립한 경우 일차표준품과 관련하여 상기에 언급된 용도에 대해 통상적인 품질관리 목적으로 사용될 수 있습니다."
계속 읽으시려면 로그인하거나 계정을 생성하세요.
계정이 없으십니까?