標的タンパク質分解
近年、治療が困難な疾患に対処する創薬戦略として発展しているモダリティーが標的タンパク質分解です。伝統的な低分子医薬または抗体医薬でアプローチ可能なプロテオームは現状約20%にとどまる一方で、標的タンパク質分解技術により残り約80%のプロテオームへアプローチが可能になるといわれています。こうしたアプローチに使用される分子はしばしばタンパク質分解誘導化合物 - 例えば、PROTAC® (PROteolysis TArgeting Chimeras、タンパク質分解誘導キメラタンパク質)- と呼ばれており、細胞内から標的タンパク質を排除する機能性分子です(図1)。
*PROTAC®はArvinas Operations, Inc.,の登録商標であり、同社の許諾を得て使用しています。
タンパク質分解誘導キメラタンパク質(PROTAC)化合物による標的タンパク質分解
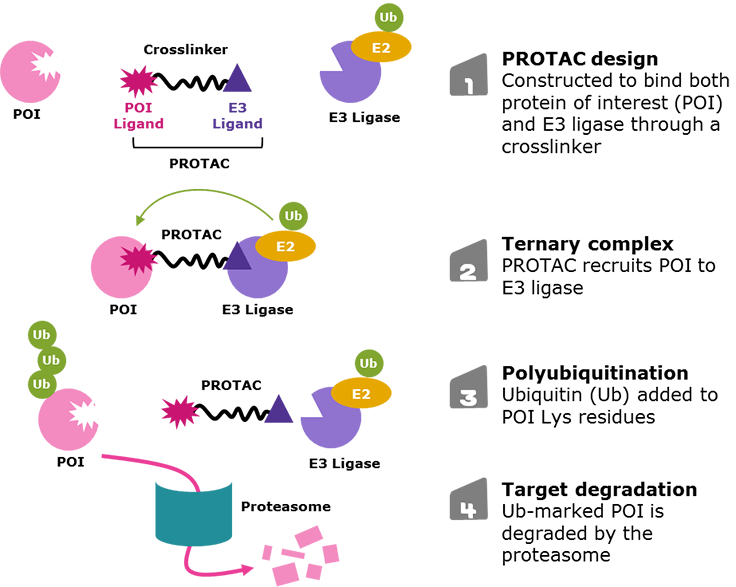
図1.タンパク質分解誘導キメラタンパク質(PROTAC)化合物による標的タンパク質分解
PROTAC化合物は以下の3種類の構成要素によりデザインされます:
- 一方の末端に標的タンパク質(POI)と結合するためのリガンド
- 他方の末端にE3リガーゼと結合するリガンド
- 両末端リガンドをつなぐクロスリンカー(図2)。
PROTAC化合物がPOIとE3ユビキチンリガーゼに同時に結合することで、POIをE2ユビキチン結合酵素に十分に接近させポリユビキチン化し、ユビキチン・プロテアソーム系によるタンパク質分解へと誘導します。
PROTAC研究の第一人者、米国ダンディー大学 Alessio Ciulli教授によるウェビナーはこちら:Targeted protein degradation using small molecules
タンパク質分解やPROTAC研究のためのタンパク質分解誘導化合物合成用ビルディングブロック
両リガンドやクロスリンカーのわずかな構造的な違いは、POIおよびE3リガーゼへの結合や複合体形成に影響を及ぼします。そのため、標的分解化合物の設計は容易ではありません。このような背景から、構造が少しずつ異なる多数の類似体ライブラリが合成され、標的分解に最適なPROTACまたは分解誘導化合物を見つけ出すために細胞でスクリーニングされています。このライブラリ構築を円滑化するため、Sigma-Aldrichでは多様なタンパク質分解誘導化合物合成用ビルディングブロックを提供しています。個々のビルディングブロックはクロスリンカーとE3リガーゼリガンドの複合体で、標的リガンドと共有結合形成するための反応性官能基を有しています(図2)。さらに、一連のビルディングブロックは同じ官能基を有するため、1つの標的リガンドは複数のビルディングブロックと並列的に結合させることが可能です。これにより、分解誘導化合物ライブラリ構築と、それに続くスクリーニングが容易になります(図3)。
分解誘導化合物のビルディングブロックは以下の要素を組み合わせたものです:
- E3リガーゼCereblon(CRBN)またはvon Hippel–Lindau (VHL)を標的とするリガンド
- 長さと組成の異なるクロスリンカー
- 共通の官能基に反応性を示す結合部位
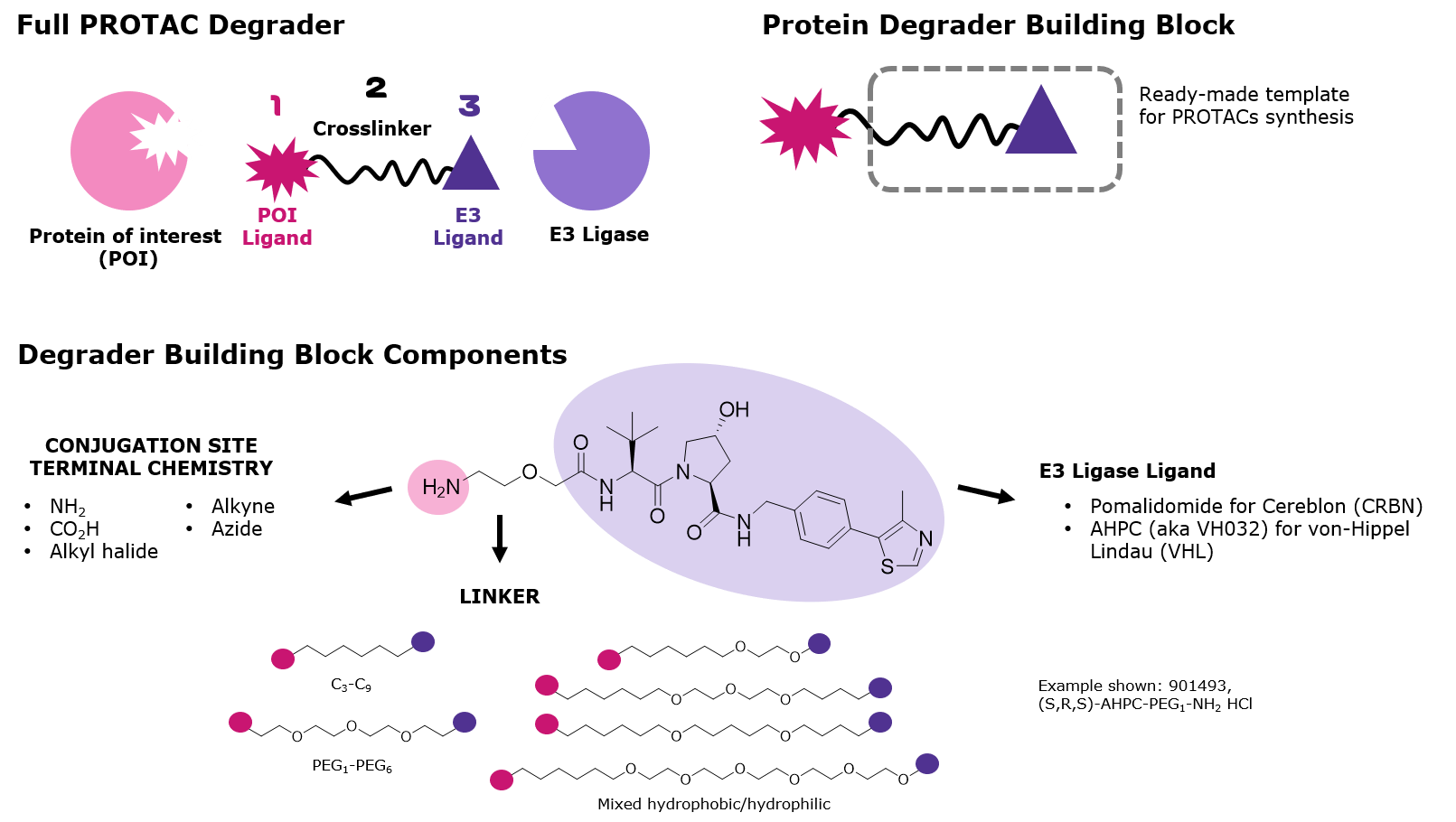
図2.PROTAC化合物の構成要素とPartial PROTAC
利点
- 適合性:リンカーは標的リガンド上に存在する共通の官能基と結合します
- 分子デザイン:戦略的にリンカーとリガンドのさまざまな組み合わせを検討することにより、より合理的なPROTACデザインが可能になります
- 合成時間の短縮:E3リガンドとクロスリンカーの複合体が準備されているため、PROTACライブラリ合成の時間が短縮されます
- ライブラリ構築:同じ結合部位を持つPROTACビルディングブロックを使用することで、何種類かのPROTACを並列同時合成することができます。
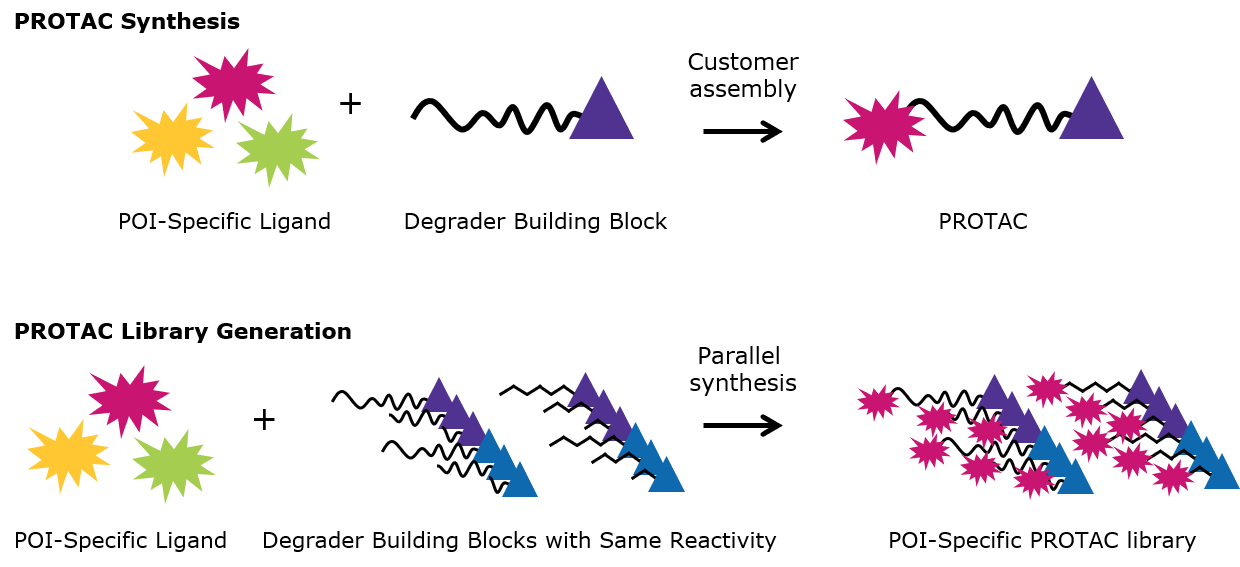
図3.PROTAC合成とPROTACライブラリ構築
| 分解化合物のビルディングブロックをうまく利用することにより、PROTACタンパク質分解化合物の合成が簡素化されます。 |
| 同じ結合部位を持つ複数の構築ブロックをセットとして利用することにより、ライブラリ構築が円滑に進みます。 |
タンパク質分解化合物の構築ブロックおよびクロスリンカーについての情報、バルク購入、ChemDraw/sdfファイルの入手について、詳しくはお問い合わせください。
参考文献
続きを確認するには、ログインするか、新規登録が必要です。
アカウントをお持ちではありませんか?