MABS1254
Anticorps anti-O-GlcNAc, clone CTD110.6
clone CTD110.6, from mouse
Synonyme(s) :
O-GlcNAc, beta-O-GlcNAc, O-Linked N-Acetylglucosamine, beta-O-linked N-acetylglucosamine
About This Item
Produits recommandés
Source biologique
mouse
Niveau de qualité
Forme d'anticorps
purified immunoglobulin
Type de produit anticorps
primary antibodies
Clone
CTD110.6, monoclonal
Réactivité de l'espèce (prédite par homologie)
all
Technique(s)
ELISA: suitable
immunoprecipitation (IP): suitable
western blot: suitable
Isotype
IgMκ
Modification post-traductionnelle de la cible
glycosylation
Informations sur le gène
human ... OGT(8473)
Description générale
Spécificité
Immunogène
Application
Analyse ELISA : Un lot représentatif a permis de détecter un peptide contenant le domaine C-terminal (CTD) de l'ARN polymérase II (YSPTSPS) et comportant un seul résidu sérine ou thréonine O-GlcNAcylé, mais pas le peptide non modifié correspondant (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
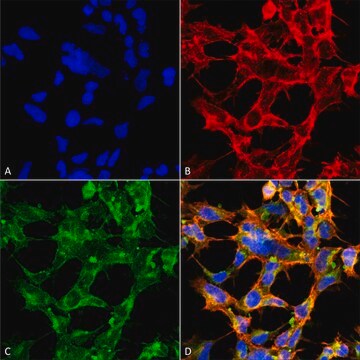
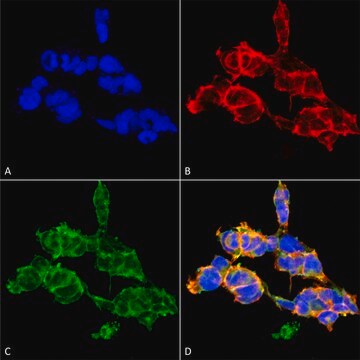
Analyse par immunoprécipitation : Un lot représentatif a permis d'immunoprécipiter des protéines O-GlcNAcylées à partir de cellules souches pluripotentes humaines (CSPh) (Maury, J.J., et al. (2013). Stem Cell Res. 11(2):926-937).
Analyse par immunoprécipitation : Un lot représentatif a permis d'immunoprécipiter des protéines O-GlcNAcylées à partir d'extraits de cellules HeLa (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
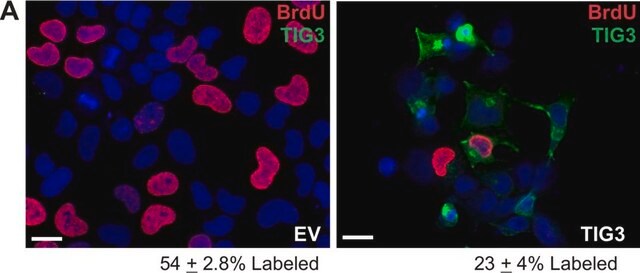
Analyse par western blotting : Un lot représentatif a permis de détecter un niveau similaire de O-GlcNAcylation dans des cellules souches pluripotentes humaines (CSPh) non différenciées, en cours de différenciation et ayant atteint le stade final de leur différenciation (Maury, J.J., et al. (2013). Stem Cell Res. 11(2):926-937).
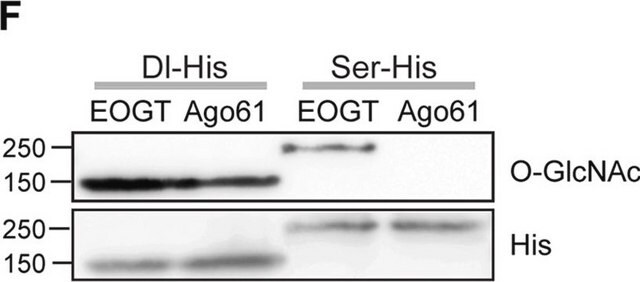
Analyse par western blotting : Un lot représentatif a permis de détecter un peptide contenant le domaine C-terminal (CTD) de l'ARN polymérase II (YSPTSPS) conjugué à de la BSA et comportant un groupement GlcNAc à liaison bêta en O, mais pas à liaison alpha en O, ni le peptide non modifié correspondant. La présence de GlcNAc a supprimé la détection des bandes cibles, mais pas la présence de GalNAc (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
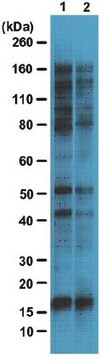
Analyse par western blotting : Un lot représentatif a permis de détecter des protéines O-GlcNAcylées dans un extrait nucléaire de cellules HeLa, ainsi que des protéines O-GlcNAcylées purifiées à partir d'un extrait cytosolique et nucléaire de cellules HeLa, avec une colonne contenant de l'agglutinine de germe de blé (WGA). Le blocage de l'anticorps par un peptide immunogène avant immunoblotting a supprimé la détection des bandes cibles (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
Analyse par western blotting : Un lot représentatif a permis de détecter une régulation à la hausse des protéines O-GlcNAcylées dans des cellules Jurkat traitées avec du PUGNAc, un inhibiteur de glucosaminidase, et de la glucosamine, un intermédiaire de la voie de l'hexosamine (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169-177).
Signalisation
Modifications post-traductionnelles générales
Qualité
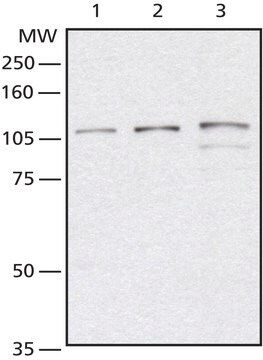
Analyse par western blotting : Une concentration de 4,0 µg/ml de cet anticorps a permis de détecter des protéines O-GlcNAcylées dans 10 µg de lysat de cellules HeLa.
Description de la cible
Forme physique
Stockage et stabilité
Autres remarques
Clause de non-responsabilité
Vous ne trouvez pas le bon produit ?
Essayez notre Outil de sélection de produits.
Code de la classe de stockage
10 - Combustible liquids
Classe de danger pour l'eau (WGK)
WGK 2
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Certificats d'analyse (COA)
Recherchez un Certificats d'analyse (COA) en saisissant le numéro de lot du produit. Les numéros de lot figurent sur l'étiquette du produit après les mots "Lot" ou "Batch".
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique