G1135
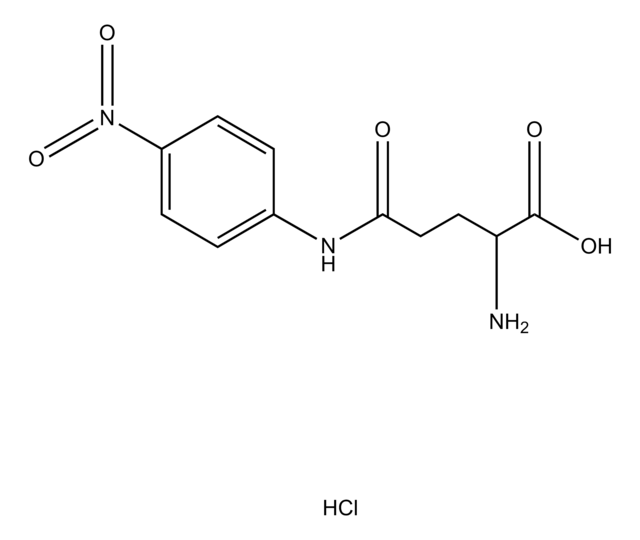
L-Glutamic acid γ-(4-nitroanilide)
γ-glutamyl transpeptidase substrate
Sinónimos:
L-γ-Glutamyl-p-nitroanilide, L-Glutamic acid 5-(4-nitroanilide)
About This Item
Productos recomendados
Análisis
≥98% (HPLC)
formulario
powder
solubilidad
formic acid: 50 mg/mL, clear to slightly hazy
temp. de almacenamiento
2-8°C
cadena SMILES
N[C@@H](CCC(=O)Nc1ccc(cc1)[N+]([O-])=O)C(O)=O
InChI
1S/C11H13N3O5/c12-9(11(16)17)5-6-10(15)13-7-1-3-8(4-2-7)14(18)19/h1-4,9H,5-6,12H2,(H,13,15)(H,16,17)/t9-/m0/s1
Clave InChI
WMZTYIRRBCGARG-VIFPVBQESA-N
¿Está buscando productos similares? Visita Guía de comparación de productos
Sustratos
Código de clase de almacenamiento
11 - Combustible Solids
Clase de riesgo para el agua (WGK)
WGK 3
Punto de inflamabilidad (°F)
Not applicable
Punto de inflamabilidad (°C)
Not applicable
Equipo de protección personal
Eyeshields, Gloves, type N95 (US)
Certificados de análisis (COA)
Busque Certificados de análisis (COA) introduciendo el número de lote del producto. Los números de lote se encuentran en la etiqueta del producto después de las palabras «Lot» o «Batch»
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Los clientes también vieron
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico