49180
Glucosa oxidasa from Aspergillus niger
lyophilized, powder, ~200 U/mg
Sinónimos:
β-D-Glucosa:oxígeno 1-oxidorreductasa, G.Od., GOx
About This Item
Productos recomendados
origen biológico
Aspergillus niger
Formulario
powder
calidad
lyophilized
actividad específica
~200 U/mg
mol peso
Mr ~186000
actividad extraña
catalase ≤1%
Condiciones de envío
dry ice
temp. de almacenamiento
−20°C
InChI
1S/C6H12O6/c7-1-2-3(8)4(9)5(10)6(11)12-2/h2-11H,1H2/t2-,3-,4+,5-,6-/m1/s1
Clave InChI
WQZGKKKJIJFFOK-VFUOTHLCSA-N
¿Está buscando productos similares? Visita Guía de comparación de productos
Descripción general
pI: 4,2
Coeficiente de extinción: E1% = 16,7 (280 nm)
La glucosa oxidasa de Aspergillus niger es un dímero que consta de dos subunidades iguales con un peso molecular de 80 kDa cada una. Cada subunidad contiene un resto del dinucleótido de flavina y adenina y un hierro. La enzima es una glucoproteína que contiene ~16 % de azúcares neutros y un 2 % de amino azúcares. La enzima también contiene 3 restos de cisteína y 8 posibles sitios para glucosilación ligada a N.
La glucosa oxidasa es capaz de oxidar D-aldohexosas, monodesoxi-D-glucosas y metil-D-glucosas a velocidades variables.
El pH óptimo para la glucosa oxidasa es de 5,5, si bien tiene un amplio espectro de actividad a valores de pH de 4 a 7. La glucosa oxidasa es específica para la β-D-glucosa con una KM de 33-110 mM.
La glucosa oxidasa no requiere activadores, pero es inhibida por Ag+, Hg2+, Cu2+, el acetato fenilmercúrico y el p-cloromercuribenzoato. No es inhibida por los reactivos SH no metálicos:. N-etilmaleimida, yodoacetato y yodoacetamida.
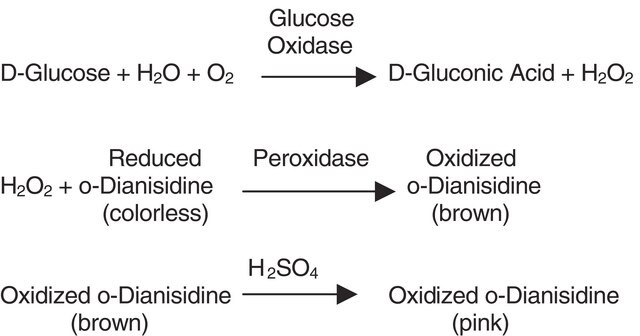
La glucosa oxidasa puede utilizarse en la determinación enzimática de la D-glucosa en disolución. Como la glucosa oxidasa oxida la β-D-glucosa a D-gluconolactato y peróxido de hidrógeno, suele utilizarse la peroxidasa de rábano picante como enzima de acoplamiento para la determinación de la glucosa. La glucosa oxidasa es específica para la β-D-glucosa, pero pueden cuantificarse disoluciones de D-glucosa ya que la α-D-glucosa mutorrotará a β-D-glucosa a medida que la β-D-glucosa va siendo consumida por la reacción enzimática.
Aplicación
Acciones bioquímicas o fisiológicas
Definición de unidad
Palabra de señalización
Danger
Frases de peligro
Consejos de prudencia
Clasificaciones de peligro
Resp. Sens. 1
Código de clase de almacenamiento
11 - Combustible Solids
Clase de riesgo para el agua (WGK)
WGK 1
Equipo de protección personal
dust mask type N95 (US), Eyeshields, Faceshields, Gloves
Elija entre una de las versiones más recientes:
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Los clientes también vieron
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico