TRYPSEQ-RO
Roche
Tripsina de calidad de secuenciación
from bovine pancreas
Sinónimos:
tripsina
Iniciar sesiónpara Ver la Fijación de precios por contrato y de la organización
About This Item
Productos recomendados
origen biológico
bovine pancreas
Nivel de calidad
Formulario
lyophilized (salt-free)
actividad específica
≥80 units/mg protein
mol peso
Mr 23.5 kDa
envase
pkg of 4 × 100 μg (11047841001)
pkg of 4 × 25 μg (11418475001)
fabricante / nombre comercial
Roche
pH óptimo
8.0
temp. de almacenamiento
2-8°C
Categorías relacionadas
Descripción general
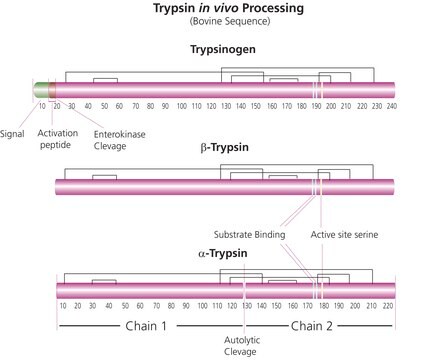
La tripsina de calidad de secuenciación se aísla del páncreas bovino como una proteasa muy purificada y específica. La tripsina de calidad de secuenciación es una endopeptidasa de serina. Escinde específicamente los enlaces peptídico en el lado carboxílico de los aminoácidos básicos Arg y Lys. También se escinden los enlaces amida y éster de la Arg y la Lys.
Especificidad
La especificidad de la tripsina de calidad de secuenciación se verifica con la cadena B de la insulina oxidada (insulina Box) como sustrato. Se incuban elevadas concentraciones de tripsina de grado de secuenciación (1 parte por peso de enzima con 18 partes por peso de insulina Box) durante 18 horas para detectar trazas de impurezas de quimiotripsina.
Especificidad (HPLC, con insulina Box):
Escisión después de 1 hora: ≥90 %
Productos de escisión inespecífica después de 18 horas: ≤10%
Especificidad (HPLC, con insulina Box):
Escisión después de 1 hora: ≥90 %
Productos de escisión inespecífica después de 18 horas: ≤10%
Aplicación
La tripsina de grado de secuenciación se utiliza para digerir las proteínas en disolución, en geles o en membranas de transferencia.
La enzima se utiliza para dilucidar la estructura de proteínas, la determinación del mapa tríptico, análisis de huellas, análisis de secuencias y estudios de translocación. La tripsina de calidad de secuenciación genera glucopéptidos a partir de glucoproteínas purificadas y es adecuada para la digestión de proteínas en geles de poliacrilamida.
La enzima se utiliza para dilucidar la estructura de proteínas, la determinación del mapa tríptico, análisis de huellas, análisis de secuencias y estudios de translocación. La tripsina de calidad de secuenciación genera glucopéptidos a partir de glucoproteínas purificadas y es adecuada para la digestión de proteínas en geles de poliacrilamida.
Calidad
Pureza: Carece de impurezas que puedan interferir en la separación de los péptidos en HPLC de fase inversa.
Nota de preparación
Estabilizadores: La tripsina es estable en 4 M.
Concentración de trabajo: de 1/100 a 1/20 de la proteína por peso (en disolución); 1-5 μg/100 μl (para digestión en gel)
Condiciones de almacenamiento (disolución de trabajo): Una disolución de ácido trifluoroacético (TFA) al 0,01% (v/v) o de HCl 1 mM puede utilizarse como máximo durante una semana si se conserva entre 2 y 8 °C. Mediante incubación de proteínas en disolución a valores de pH entre neutros y ligeramente básicos puede producirse una autólisis parcial. Para esta aplicación, Roche recomienda tripsina modificada, calidad de secuenciación.
Concentración de trabajo: de 1/100 a 1/20 de la proteína por peso (en disolución); 1-5 μg/100 μl (para digestión en gel)
Condiciones de almacenamiento (disolución de trabajo): Una disolución de ácido trifluoroacético (TFA) al 0,01% (v/v) o de HCl 1 mM puede utilizarse como máximo durante una semana si se conserva entre 2 y 8 °C. Mediante incubación de proteínas en disolución a valores de pH entre neutros y ligeramente básicos puede producirse una autólisis parcial. Para esta aplicación, Roche recomienda tripsina modificada, calidad de secuenciación.
Reconstitución
Para estabilidad de la disolución es necesaria la reconstitución en ácido: Se recomiendan TFA al 0,01% (v/v), HCl 1 mM o ácido acético al 0,1%.
Otras notas
Sólo para investigación en ciencias de la vida. No indicada para procedimientos diagnósticos.
Palabra de señalización
Danger
Frases de peligro
Consejos de prudencia
Clasificaciones de peligro
Eye Irrit. 2 - Resp. Sens. 1 - Skin Irrit. 2 - STOT SE 3
Órganos de actuación
Respiratory system
Código de clase de almacenamiento
11 - Combustible Solids
Clase de riesgo para el agua (WGK)
WGK 1
Punto de inflamabilidad (°F)
does not flash
Punto de inflamabilidad (°C)
does not flash
Elija entre una de las versiones más recientes:
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Los clientes también vieron
Saeedreza Vessal et al.
Journal of proteome research, 11(8), 4289-4307 (2012-07-07)
Protein expression patterns in imbibed seeds of three cultivars of chickpea (Cicer arietinum L.) with different rates of germination under limiting water supply in soil (>10% water holding capacity) were compared. A large number of soluble proteins expressed earlier and
Jesper V Olsen et al.
Molecular & cellular proteomics : MCP, 3(6), 608-614 (2004-03-23)
Almost all large-scale projects in mass spectrometry-based proteomics use trypsin to convert protein mixtures into more readily analyzable peptide populations. When searching peptide fragmentation spectra against sequence databases, potentially matching peptide sequences can be required to conform to tryptic specificity
Petra A Neff et al.
Chemphyschem : a European journal of chemical physics and physical chemistry, 8(14), 2133-2137 (2007-08-28)
A silicon-on-insulator (SOI) based thin film resistor is employed for the label-free determination of enzymatic activity. We demonstrate that enzymes, which cleave biological polyelectrolyte substrates, can be detected by the sensor. As an application, we consider the serine endopeptidase trypsin
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico