Wichtige Dokumente
N2876
Neuraminidase aus Clostridium perfringens (C. welchii)
Suitable for manufacturing of diagnostic kits and reagents, Type V, lyophilized powder
Synonym(e):
Acyl-neuraminyl-Hydrolase, Receptor-destroying enzyme, Sialidase
About This Item
Empfohlene Produkte
Qualitätsniveau
Typ
Type V
Form
lyophilized powder
Spezifische Aktivität
≥0.1 units/mg solid (using mucin)
≥1.3 units/mg solid (using 4MU-NANA)
Anwendung(en)
diagnostic assay manufacturing
Fremdaktivität
Protease and NAN-aldolase, present
Versandbedingung
dry ice
Lagertemp.
−20°C
Angaben zum Gen
Clostridium perfringens str. 13 ... nanI(988807)
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
Allgemeine Beschreibung
Anwendung
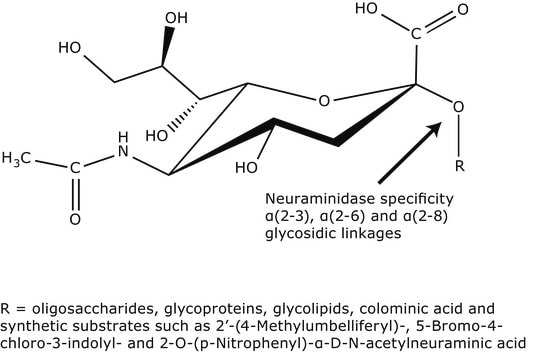
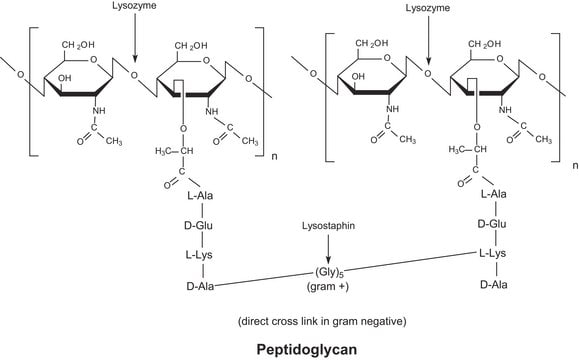
Biochem./physiol. Wirkung
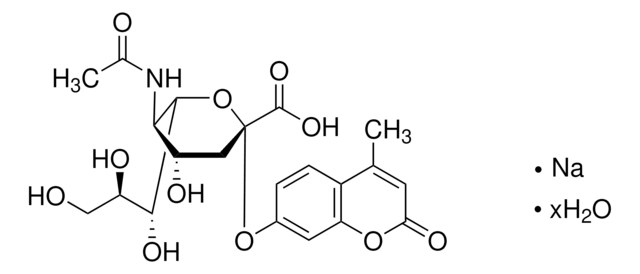
Einheitendefinition
Eine Einheit hydrolysiert je Minute bei einem pH-Wert von 5,0 und 37 °C 1,0 Mikromol 2′-(4-Methylumbelliferyl)-α-D-N-acetylnumeraminsäure (unter Verwendung von 4MU-NANA als Substrat).
Angaben zur Herstellung
Hinweis zur Analyse
Signalwort
Danger
H-Sätze
P-Sätze
Gefahreneinstufungen
Resp. Sens. 1
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 1
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Persönliche Schutzausrüstung
Eyeshields, Gloves, type N95 (US)
Hier finden Sie alle aktuellen Versionen:
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Protokolle
Enzymatic Assay of Neuraminidase applies to products that have a specification for neuraminidase content by enzymatic determination.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.