H8916
Tumornekrosefaktor-α human
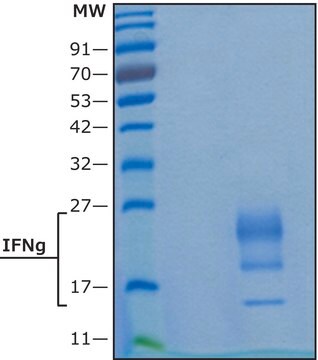
≥95% (SDS-PAGE), recombinant, expressed in HEK 293 cells, lyophilized powder, suitable for cell culture
Synonym(e):
TNF-α
About This Item
Empfohlene Produkte
product name
Tumornekrosefaktor-α human, Xeno-free, recombinant, expressed in HEK 293 cells, suitable for cell culture
Biologische Quelle
human
Qualitätsniveau
Rekombinant
expressed in HEK 293 cells
Assay
≥95% (SDS-PAGE)
Form
lyophilized powder
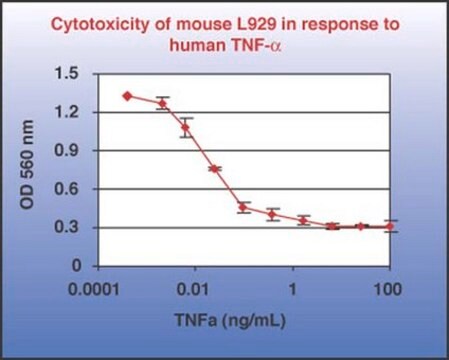
Wirksamkeit
≤1.0 ng/mL ED50
Qualität
endotoxin tested
Mol-Gew.
17 kDa (glycosylated)
~17.4 kDa
Verpackung
pkg of 10 μg
Lagerbedingungen
avoid repeated freeze/thaw cycles
Methode(n)
cell culture | mammalian: suitable
Verunreinigungen
≤1.00 EU/μg (endotoxin)
UniProt-Hinterlegungsnummer
Lagertemp.
−20°C
Angaben zum Gen
human ... TNF(7124)
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
Allgemeine Beschreibung
Anwendung
- Bei der Induktion der Vernetzung von Neutrophilen mittels antineutrophiler zytoplasmatischer Autoantikörper und um deren Wirkung auf die Plättchenaktivierung und Bildung des monomeren C-reaktiven Proteins zu untersuchen.
- Zum Untersuchen der Wirkung des TNF-α auf miR-221 und die Fractalkine-Expression.
- Zur Induktion von zellulären Entzündungsreaktionen.
- In NF-κB Luciferase Reporter Assays.
- Als ein Permeabilität auslösendes Mittel für Permeabilitäts-Assays von endothelialen Zellmonoschichten
- Als Induktor von reaktiven Sauerstoffspezies in primären kardialen mikrovaskulären Endothelzellen von Ratten (RCMVECs)
- Bei der Aktivierung von Nuklearfaktor-kappa-B (NF-κB) in menschlichen embryonalen Nierenzellen (HEK293), SH-SY5Y-Neuroblastomzellen und HeLa-Zellen
- Bei der Stimulierung der menschlichen Keratinozytenzellline (HaCaT) und den menschlichen Koronararterien-Endothelzellen (HCAECs)
Biochem./physiol. Wirkung
Angaben zur Herstellung
Hinweis zur Analyse
Vergleichbares Produkt
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 2
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
2 Replication of Classical Swine Fever Virus
Artikel
Lipid Induced Insulin Resistance
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.