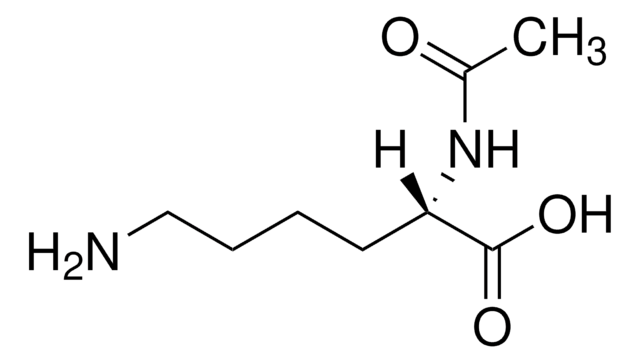
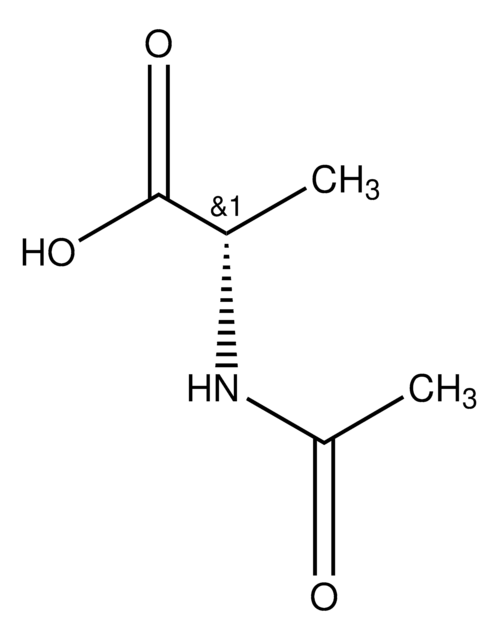
A4021
Nε-Acetyl-L-lysin
≥98% (TLC)
Synonym(e):
N6-acetyl-L-lysine
About This Item
Empfohlene Produkte
product name
Nε-Acetyl-L-lysin,
Assay
≥98% (TLC)
Qualitätsniveau
Form
powder
Konzentration
50 mg/mL in 80% acetic acid
Farbe
colorless to white
mp (Schmelzpunkt)
250 °C (dec.) (lit.)
Lagertemp.
−20°C
SMILES String
CC(=O)NCCCC[C@H](N)C(O)=O
InChI
1S/C8H16N2O3/c1-6(11)10-5-3-2-4-7(9)8(12)13/h7H,2-5,9H2,1H3,(H,10,11)(H,12,13)/t7-/m0/s1
InChIKey
DTERQYGMUDWYAZ-ZETCQYMHSA-N
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
Anwendung
- Nε-Acetyl L-α Lysine Improves Activity and Stability of α-Amylase at Acidic Conditions: A Comparative Study with other Osmolytes. Diese Studie unterstreicht die Verwendung von Nε-Acetyl-ʟ-Lysin zur Verbesserung der funktionalen Stabilität und Aktivität von α-Amylase in einem sauren Milieu und zeigt dessen Potenzial als wertvolles Additiv in industriellen Enzymanwendungen (Joghee et al., 2020).
Biochem./physiol. Wirkung
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 3
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.