PF024
MMP-9, aktiv, human, rekombinant
Synonym(e):
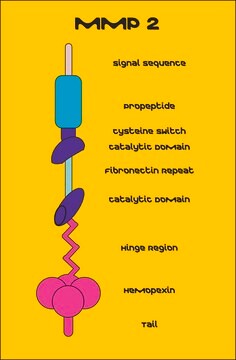
Matrix-Metalloproteinase 9, Gelatinase B, 83 kDa Gelatinase
About This Item
Empfohlene Produkte
Assay
≥90% (SDS-PAGE)
Qualitätsniveau
Form
liquid
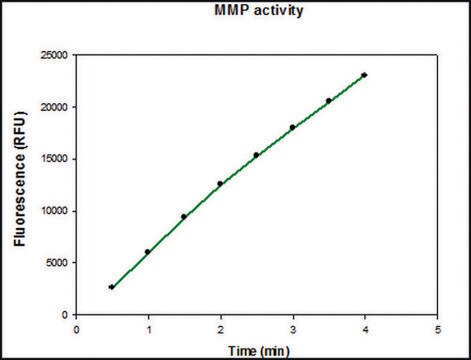
Spezifische Aktivität
≥8.0 ΔA405/h-μg protein (thiopeptide hydrolysis assay)
Enthält nicht
preservative
Hersteller/Markenname
Calbiochem®
Lagerbedingungen
OK to freeze
avoid repeated freeze/thaw cycles
Versandbedingung
wet ice
Lagertemp.
−70°C
Allgemeine Beschreibung
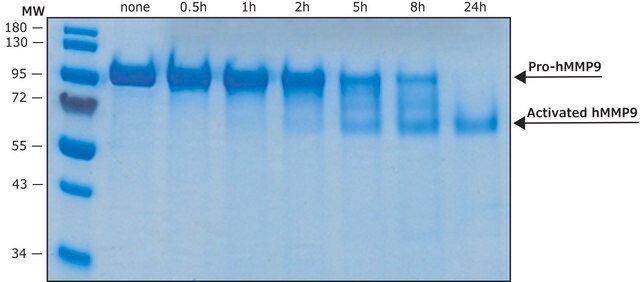
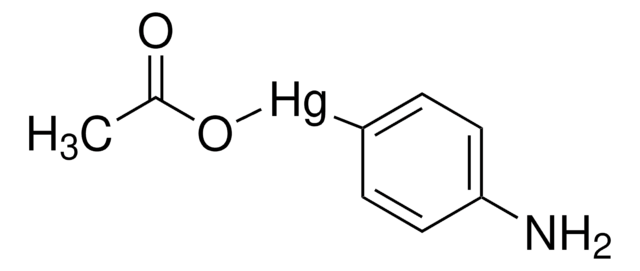
Die Regulation der MMP-Aktivität kann auf der Ebene von Genexpression einschließlich Transkription und Translation, auf Aktivierungsebene oder der Ebene einer Hemmung durch TIMPs stattfinden. Daher können Störungen an jedem dieser Punkte theoretisch zu Änderungen beim EZM-Turnover führen. Die Expression wird von pro- und antiinflammatorischen Zytokinen bzw. Wachstumsfaktoren genau gesteuert, und wenn die Enzyme erzeugt sind, werden sie normalerweise als inaktive Zymogramme ausgeschieden. Nach der Aktivierung (Entfernung der inhibitorischen Propeptidregion des Moleküls) werden MMPs durch lokal erzeugte TIMPs gesteuert. Alle MMPs können in vitro mit quecksilberorganischen Verbindungen (z. B. 4-Aminophenylquecksilberacetat) aktiviert werden, aber die für die physiologische Aktivierung aller MMPs verantwortlichen Wirkstoffe sind bisher nicht eindeutig identifiziert. Zahlreiche Studien legen nahe, dass Enzyme der MMP-Familie die Fähigkeit haben, sich gegenseitig zu aktivieren. Die Aktivierung der MMPs in vivo ist vermutlich ein wichtiger Schritt im Hinblick auf ihr biologisches Verhalten, da diese Aktivierung den EZM-Abbau begünstigt. Ein wichtiges Krankheitsmerkmal im Zusammenhang mit MMPs scheint ein stöchiometrisches Ungleichgewicht zwischen aktiven MMPs und TIMPs zu sein, das zu übermäßigem Gewebeaufschluss und oft der Zerstörung führt. Die Bestimmung der Mechanismen, die dieses Ungleichgewicht steuern, können potenziell wichtige therapeutische Möglichkeiten bestimmter Enzymhemmer öffnen
Verpackung
Warnhinweis
Physikalische Form
Rekonstituierung
Sonstige Hinweise
Backstrom, J. R. et al., 1996. J. Neuro.16, 7910.
Lim, G. P. et al., 1996. J. Neurochem.67, 251.
Xia, T. et al., 1996. Biochim. Biophys. Acta1293, 259.
Sang, Q. X. et al., 1995. Biochim. Biophys. Acta1251, 99.
Zempo, N. et al., 1994. J. Vasc. Surg.20, 217.
Birkedal-Hansen, H.. 1993. J. Periodontol.64, 484.
Stetler-Stevenson, W. G. et al., 1993. FASEB J.7, 1434.
Jeffrey, J. J., 1991. Semin. Perinatol.15, 118.
Liotta, L. A. et al., 1991. Cell64, 327.
Harris, E. 1990. N. Engl. J. Med.322, 1277.
Rechtliche Hinweise
Lagerklassenschlüssel
10 - Combustible liquids
WGK
WGK 1
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.