MABS1254
Anti-O-GlcNAc-Antikörper, Klon CTD110.6
clone CTD110.6, from mouse
Synonym(e):
O-GlcNAc, beta-O-GlcNAc, O-Linked N-Acetylglucosamine, beta-O-linked N-acetylglucosamine
About This Item
Empfohlene Produkte
Biologische Quelle
mouse
Qualitätsniveau
Antikörperform
purified immunoglobulin
Antikörper-Produkttyp
primary antibodies
Klon
CTD110.6, monoclonal
Speziesreaktivität (Voraussage durch Homologie)
all
Methode(n)
ELISA: suitable
immunoprecipitation (IP): suitable
western blot: suitable
Isotyp
IgMκ
Posttranslationale Modifikation Target
glycosylation
Angaben zum Gen
human ... OGT(8473)
Allgemeine Beschreibung
Spezifität
Immunogen
Anwendung
Signalisierung
Allgemeine posttranslationale Modifikation
ELISA-Analyse: Mit einer repräsentativen Charge wurde das Peptid mit C-terminaler Domäne (CTD) der RNA-Polymerase II (YSPTSPS) mit einem einzigen O-GlcNAcylierten Serin- oder Threoninrest, nicht jedoch das nicht modifizierte Peptid nachgewiesen (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169–177).
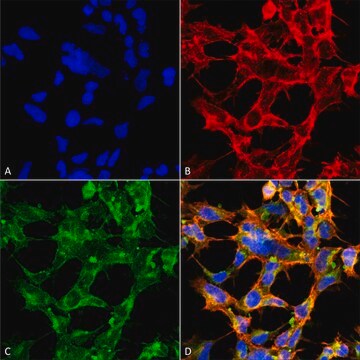
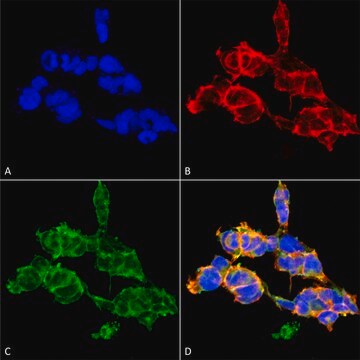
Immunpräzipitationsanalyse: Mit einer repräsentativen Charge wurden O-GlcNAcylierte Proteine aus menschlichen pluripotenten Stammzellen (human Pluripotent Stem Cells, hPSC) ausgefällt (Maury, J.J., et al. (2013). Stem Cell Res. 11(2):926–937).
Immunpräzipitationsanalyse: Mit einer repräsentativen Charge wurden O-GlcNAcylierte Proteine aus HeLa-Zellextrakten ausgefällt (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169–177).
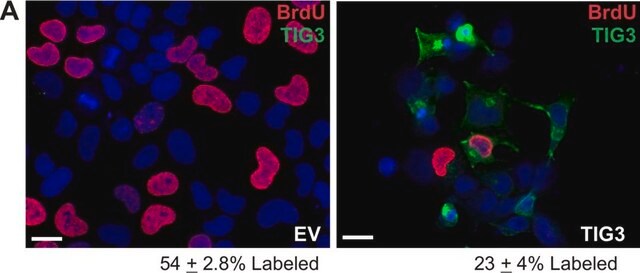
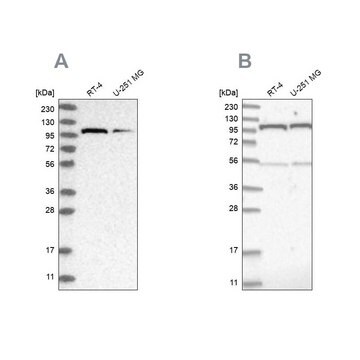
Western-Blot-Analyse: Mit einer repräsentativen Charge wurde ein ähnliches Ausmaß der O-GlcNAcylierung in undifferenzierten, differenzierenden und terminal differenzierten menschlichen pluripotenten Stammzellen (human Pluripotent Stem Cells, hPSC) nachgewiesen (Maury, J.J., et al. (2013). Stem Cell Res. 11(2):926–937).
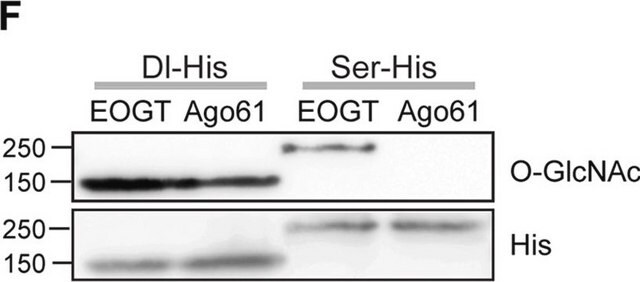
Western-Blot-Analyse: Mit einer repräsentativen Charge wurde das BSA-konjugierte Peptid mit C-terminaler Domäne (CTD) der RNA-Polymerase II (YSPTSPS) mit beta-O-verknüpftem GlcNAc, aber nicht mit alpha-O-verknüpftem GlcNAc nachgewiesen. Das entsprechende nicht modifizierte Peptid wurde ebenfalls nicht nachgewiesen. Durch die Gegenwart von GlcNAc, jedoch nicht von GalNAc, wurde der Nachweis der Zielbanden blockiert (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169–177).
Western-Blot-Analyse: Mit einer repräsentativen Charge wurden O-GlcNAcylierte Proteine in HeLa-Zellkernextrakt sowie aus HeLa-Zellkern- und zytosolischen Extrakten aufgereinigte O-GlcNAcylierte Proteine mittels WGA-Säule (Wheat Germ Agglutinin, Weizenkeimagglutinin) nachgewiesen. Durch die Antikörperblockierung durch das Immunogenpeptid vor dem Immunblot wurde der Nachweis der Zielbanden blockiert (Ho, T., et al. (2001). Anal. Biochem. 293(2):169–177).
Western-Blot-Analyse: Mit einer repräsentativen Charge wurde eine Hochregulierung der O-GlcNAcylierten Proteine in Jurkat-Zellen nachgewiesen, die mit dem Glucosaminidase-Hemmer PUGNAc und Glucosamin, dem Zwischenprodukt des Hexosamin-Signalwegs, behandelt wurden (Comer, F.I., et al. (2001). Anal. Biochem. 293(2):169–177).
Qualität
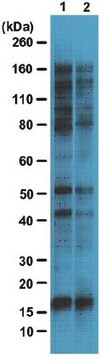
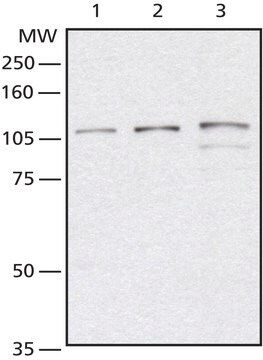
Western-Blot-Analyse: Mit 4,0 µg/ml dieses Antikörpers wurden O-GlcNAcylierte Proteine in 10 µg HeLa-Zelllysat nachgewiesen.
Zielbeschreibung
Physikalische Form
Lagerung und Haltbarkeit
Sonstige Hinweise
Haftungsausschluss
Sie haben nicht das passende Produkt gefunden?
Probieren Sie unser Produkt-Auswahlhilfe. aus.
Lagerklassenschlüssel
10 - Combustible liquids
WGK
WGK 2
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.