Protein-Pulldown
Der Pulldown-Assay dient dazu, die Interaktion von zwei oder mehr Proteinen nachzuweisen. In Affinitäts-Pulldown-Assays wird ein Zielprotein („bait“, Köder) durch kovalente Bindung oder durch ein Affinitäts-Tag, wie z.B. die immobilisierte Metallaffinitätschromatographie (IMAC), an einen immobilisierten Liganden (Trägerperlen) getaggt und eingefangen. Zu den üblichen bait-Protein Fusions-Tags gehören Glutathion-S-Transferase (GST) und Histidin-markierte Proteine. Das bait-Protein bildet einen Komplex, der dann mit einer Proteinquelle wie Zell- oder Gewebelysat inkubiert wird. Die Zielproteine werden durch eine Reihe von Waschvorgängen vom Perlenträger eluiert und durch Zentrifugation gesammelt. Die Affinitäts-Pulldown-Methode von Aufreinigung und Nachweis unterscheidet sich von Immunpräzipitations- (IP) und Co-IP-Assays dadurch, dass es sich nicht um eine Antikörper-Antigen-Interaktion handelt. Bei allen Pulldown-Assays wird die aufgereinigte Probe häufig mittels SDS-PAGE, Massenspektralanalyse und Western-Blot-Erkennung zur weiteren Downstream-Analyse analysiert.
Zugehörige technische Artikel
- Differential centrifugation and density gradient centrifugation are two types of centrifugal techniques for separating particles.CsCl gradient centrifugation, or Caesium chloride centrifugation is used to make solutions for the separation of RNA from DNA by density gradient centrifugation.
- Centrifugation enables the separation of particles by sedimentation. Learn how to separate particles using a centrifuge and how to use Stokes' law to calculate the velocity of sedimentation.
- Sera-Mag and Sera-Mag SpeedBeads provide cost effective magnetic bead separation technology for molecular biology applications, nucleic acid isolation, and research immunoassays.
- Agarose beads Vs. Magnetic beads in Chromatin Immunoprecipitation (ChIP)
- This page describes immunoprecipitation (immunoaffinity or pull-down techniques).
- Alle anzeigen (10)
Zugehörige Protokolle
- To determine the molecular weights of protein antigens, to study protein/protein interactions, to determine specific enzymatic activity, to monitor protein post-translational modifications and to determine the presence and quantity of proteins.
- Immunoprecipitation Kit (Protein G) Protocol & Troubleshooting
- Immunoprecipitation Kit (Protein A) Protocol & Troubleshooting
- Sera-Mag SpeedBeads Protein A/G Magnetic Particles provide a fast and convenient method for both manual and automated magnetic isolation of proteins using affinity binding. The particles can be used for isolating antibodies from serum, cell culture supernatant or ascites, and for immunoprecipitation and co-immunoprecipitation of antigens from cell or tissue extracts.
- The following material related to Nanodisc Technology is adapted from on-line content of the research group of Professor Stephen Sligar of the University of Illinois at Urbana-Champaign, with the kind permission of Professor Sligar.
- Alle anzeigen (14)
Mehr Artikel und Protokolle finden
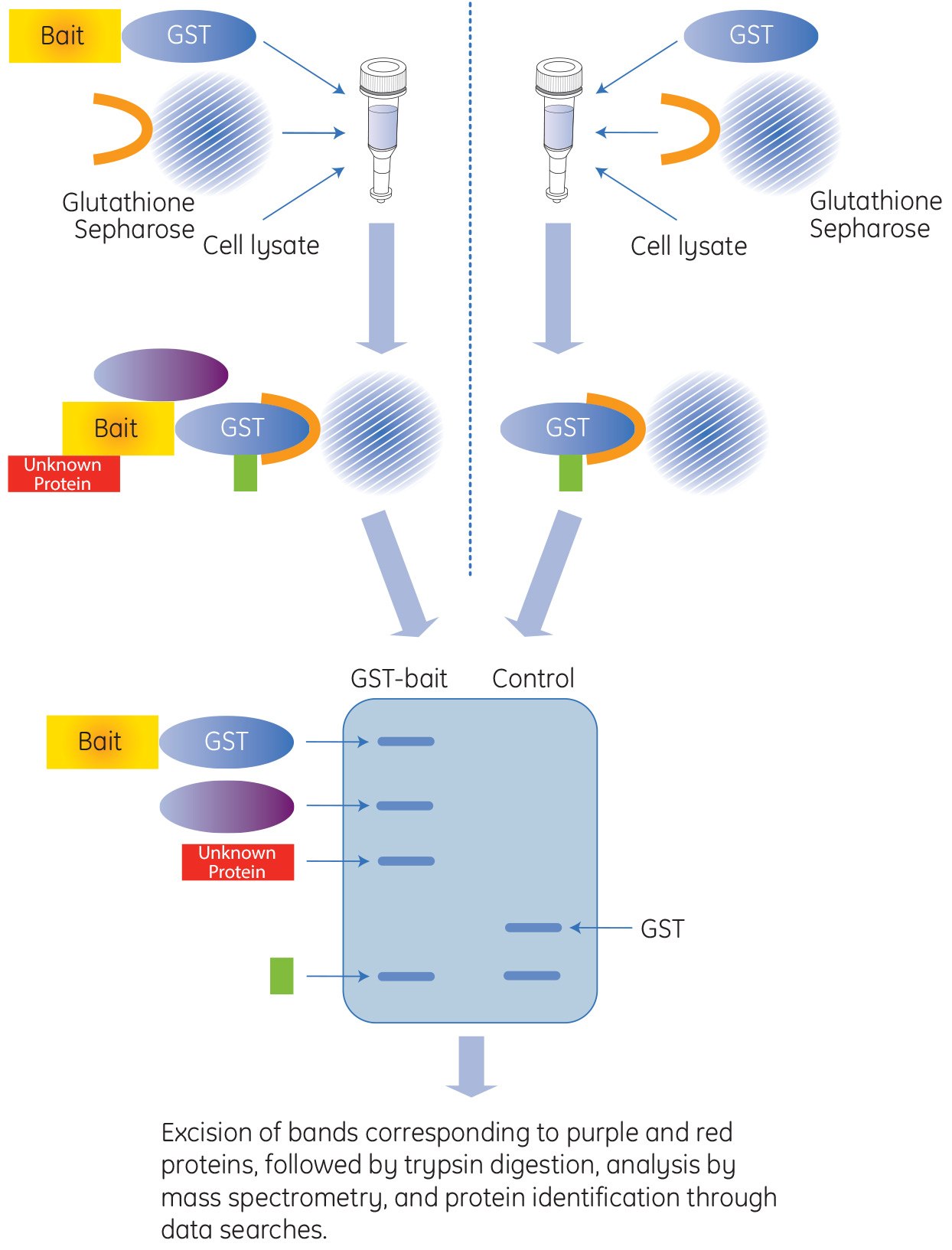
Affinitäts-GST-Pulldown-Anwendungen
Glutathion-S-Transferase (GST) ist ein Protein aus 211 Aminosäuren, das in den meisten Organismen vorkommt. GST wird häufig in Expressionsvektoren integriert, um die Fusionsmarke innerhalb von E. coli-Proteinexpressionssystemen zu erzeugen. Das GST-Tag ist ein großes Protein-Tag mit einer Größe von etwa 26 kDa und kann in Bakterien-, Hefe-, Säugetier- und Insektenzellen exprimiert werden. Das GST-Tag ist von Vorteil, wenn das rekombinante Protein vor intrazellulärer Proteasespaltung geschützt werden muss und wenn die Löslichkeit des markierten Proteins verbessert werden soll. Darüber hinaus bietet das GST-Protein ein Hochaffinitätstag für eine einfache Aufreinigung und für Pulldown-Experimente mit kostengünstigen Affinitätsharzen, die unter milden Elutionsbedingungen durchgeführt werden.
Co-Immunpräzipitation
Der Pulldown-Assay ist ideal zur Überprüfung von Co-Immunpräzipitationsergebnissen und eine ausgezeichnete Methode zur Identifizierung unbekannter Protein-Protein-Interaktionen zusammen mit dem Aktivierungsstatus spezifischer Proteine. Im Gegensatz zu Affinitäts-Pulldown-Methoden werden bei der IP Antikörper eingesetzt, um an Antigene aus komplexen biologischen Proben zu binden und diese zu isolieren.
Co-IP bezieht sich auf die Verwendung eines Antikörpers, um ein Antigen innerhalb eines Multiproteinkomplexes zu binden. Der Komplex wird dann mit der Zugabe von Protein A- oder Protein G-Medium eingefangen. Die hohe Affinität von Protein A/G zum Fc-Teil polyklonaler und monoklonaler Antikörper vom Typ IgG macht sie zu einer kritischen Komponente bei der Aufreinigung des Zielproteins oder Proteinkomplexes. Der Einsatz von Protein-Pulldown-Methoden stellt ein wichtiges Werkzeug für die Untersuchung von Protein-Protein-Interaktionsnetzwerken dar. Die Wahl der spezifischen Methode wird dabei durch den spezifischen Anwendungsbedarf des Wissenschaftlers bestimmt.
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?