R6513
Ribonucléase A from bovine pancreas
for molecular biology, ≥70 Kunitz units/mg protein, lyophilized
Synonyme(s) :
RNAse a, RNase A, Ribonucléase pancréatique, Ribonucléate 3′-pyrimidino-oligonucléotido-hydrolase
About This Item
Produits recommandés
Qualité
for molecular biology
Niveau de qualité
Forme
lyophilized
Activité spécifique
≥70 Kunitz units/mg protein
Poids mol.
13.7 kDa
~13,700
Activité étrangère
Exonuclease and endonuclease, none detected
NICKase and DNase, none detected
Température de stockage
−20°C
InChI
1S/C9H14N4O3/c10-2-1-8(14)13-7(9(15)16)3-6-4-11-5-12-6/h4-5,7H,1-3,10H2,(H,11,12)(H,13,14)(H,15,16)
Clé InChI
CQOVPNPJLQNMDC-UHFFFAOYSA-N
Vous recherchez des produits similaires ? Visite Guide de comparaison des produits
Description générale
Application
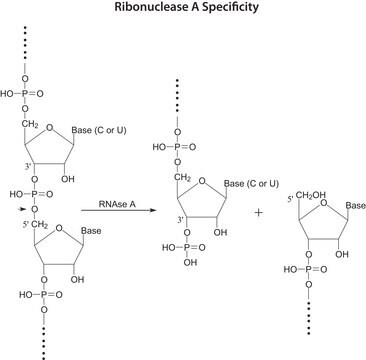
- La RNase A est utilisée pour supprimer l′ARN présent dans les préparations d′ADN plasmidique et d′ADN génomique ainsi que dans les échantillons protéiques.
- Elle est également employée dans l′analyse de séquences d′ARN et les tests de protection.
- Elle a également servi d′outil dans la conception de médicaments assistée par ordinateur.
- La RNase A supporte l′analyse des séquences d′ARN.
- Elle hydrolyse l′ARN contenu dans les échantillons protéiques.
- La purification de l′ADN est supportée par la RNase A.
- pour la purification d'ADN plasmidique
- pour digérer l'ADN double brin et éviter sa coloration lors de la coloration de noyaux
- dans des techniques de détection par immunoperoxydase et par immunofluorescence
- pour traiter des cellules avant cytométrie en flux
- comme constituant d'un tampon post-hybridation pour le lavage de coupes histologiques fixées au formol et incluses en paraffine après hybridation in situ
- pour traiter des cellules lors de la préparation d'extraits de protéines de membrane externe (OMP)
- dans des tests de protection à la RNase
- pour l'élimination d'ARN liés de manière non spécifique
- dans l'analyse de séquences d'ARN
- pour l'hydrolyse de l'ARN contenu dans des échantillons de protéines
Caractéristiques et avantages
Remarque sur l'analyse
Autres remarques
Il n′est pas nécessaire de faire bouillir des solutions mères de ce produit de RNase A pour inactiver les DNases résiduelles. Cette ébullition peut faire précipiter la RNase et entraîner une éventuelle perte d′activité enzymatique. Le chauffage d′une solution de RNase A à pH neutre provoque une précipitation. Un chauffage à pH plus bas peut produire une légère précipitation du fait des impuretés protéiques présentes.
Application
Inhibiteur
Produit(s) apparenté(s)
Mention d'avertissement
Danger
Mentions de danger
Conseils de prudence
Classification des risques
Resp. Sens. 1
Code de la classe de stockage
11 - Combustible Solids
Classe de danger pour l'eau (WGK)
WGK 3
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Équipement de protection individuelle
Eyeshields, Gloves, type N95 (US)
Faites votre choix parmi les versions les plus récentes :
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Les clients ont également consulté
Articles
Separation of null
Separation of Ribonuclease A from bovine pancreas, Type I-A, powder, ≥60% RNase A basis (SDS-PAGE), ≥50 Kunitz units/mg protein; α-Chymotrypsinogen A from bovine pancreas, essentially salt-free, lyophilized powder; Cytochrome c from bovine heart, ≥95% based on Mol. Wt. 12,327 basis; Lysozyme from chicken egg white, lyophilized powder, protein ≥90 %, ≥40,000 units/mg protein
Separation of Ribonuclease A from bovine pancreas, Type I-A, powder, ≥60% RNase A basis (SDS-PAGE), ≥50 Kunitz units/mg protein; α-Chymotrypsinogen A from bovine pancreas, essentially salt-free, lyophilized powder; Cytochrome c from bovine heart, ≥95% based on Mol. Wt. 12,327 basis; Lysozyme from chicken egg white, lyophilized powder, protein ≥90 %, ≥40,000 units/mg protein
Protocoles
This procedure may be used for determination of Ribonuclease A (RNase A) activity.
Chromatograms
application for HPLCNotre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique