L6638
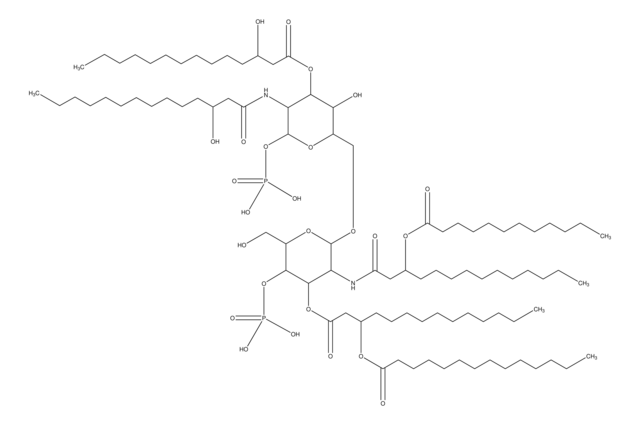
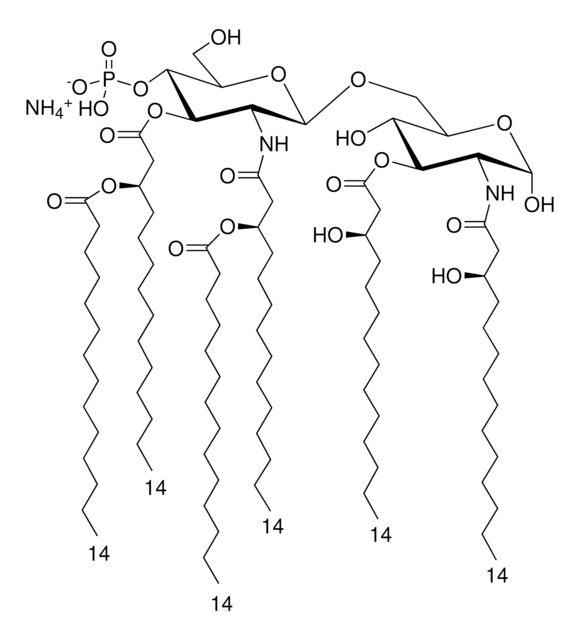
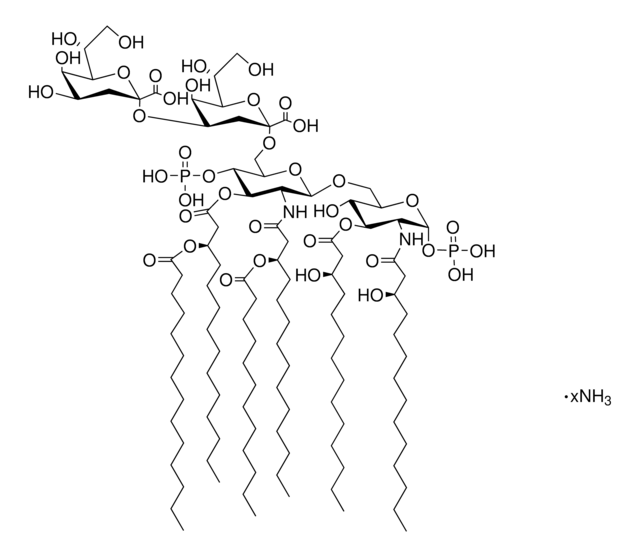
Lipid A, Monophosphoryl aus E. coli F583 (Rd-Mutante)
lyophilized powder
Synonym(e):
Lipid A, Monophosphoryl aus E. coli
Anmeldenzur Ansicht organisationsspezifischer und vertraglich vereinbarter Preise
Alle Fotos(1)
About This Item
Empfohlene Produkte
Biologische Quelle
Escherichia coli (F583 Rd mutant)
Qualitätsniveau
Form
lyophilized powder
Verunreinigungen
<0.2% Ketodeoxyoctonate (KDO)
Versandbedingung
ambient
Lagertemp.
2-8°C
Biochem./physiol. Wirkung
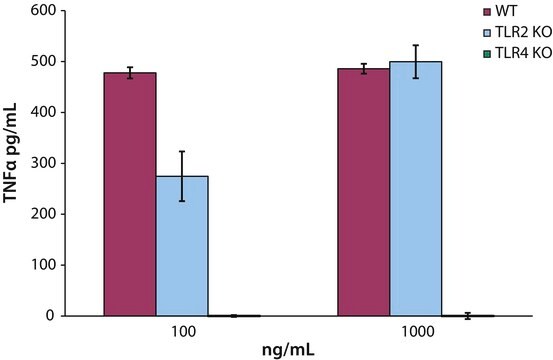
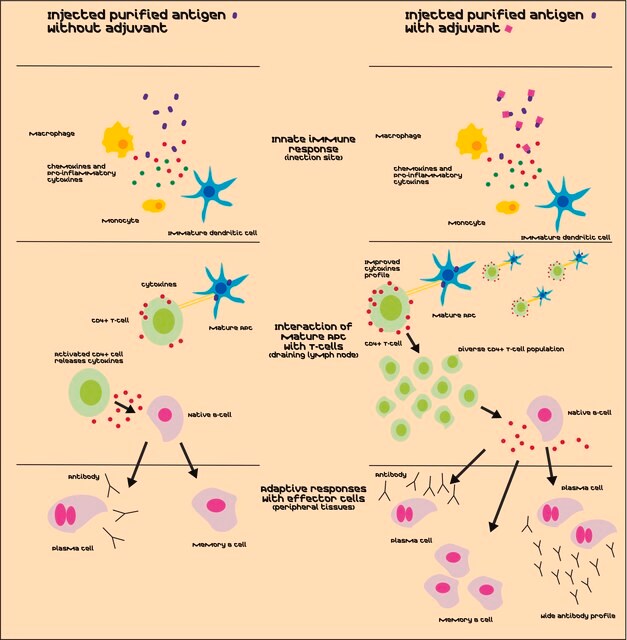
Lipid A weist eine immunstimulierende adjuvante Aktivität auf und aktiviert u. a. Makrophagen, T-Zellen und B-Zellen. Die stärkere Th1- gegenüber der Th2-Stimulierung von Lipid A wurde wissenschaftlich nachgewiesen.
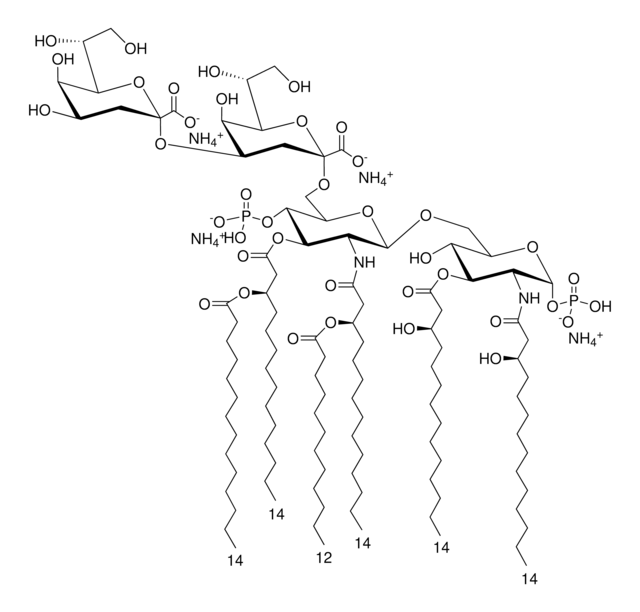
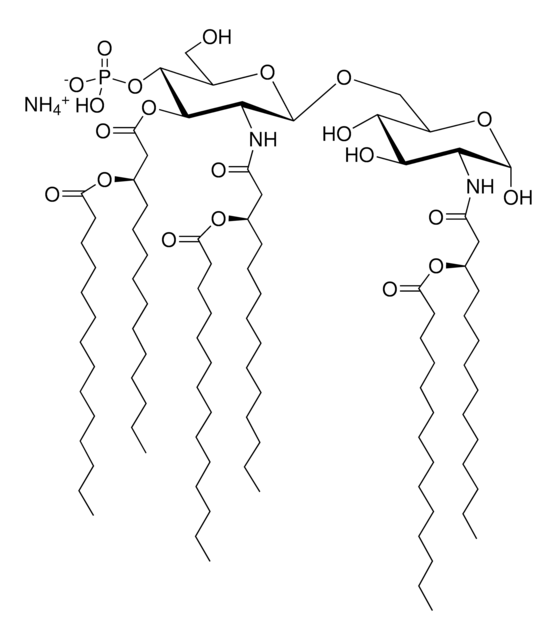
Lipid-A-Moleküle machen die Lipidmembran aus, welche die durch gramnegative Bakterien produzierten Kernkomponenten von Endotoxinen einbettet. Lipid-A-Moleküle induzieren Immunreaktionen. Strukturell bestehen Lipid-A-Moleküle aus zwei Glucosamin-Einheiten mit unterschiedlicher, speziesabhängiger Fettsäurekettenanzahl, Identität und unterschiedlichem Phosphorylierungsgrad.
Lipid A, ein Monophosphoryl aus Escherichia coli F583, kann bei Vergleichsbeurteilungen der Antigenität von spezifischen Strukturen innerhalb unterschiedlicher LPA-Moleküle und -Analoga verwendet werden.
Lipid A, ein Monophosphoryl aus Escherichia coli F583, kann bei Vergleichsbeurteilungen der Antigenität von spezifischen Strukturen innerhalb unterschiedlicher LPA-Moleküle und -Analoga verwendet werden.
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 3
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Persönliche Schutzausrüstung
Eyeshields, Gloves, type N95 (US)
Hier finden Sie alle aktuellen Versionen:
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Vincent J Venditto et al.
Clinical and vaccine immunology : CVI, 21(8), 1086-1093 (2014-05-30)
Broadly neutralizing monoclonal antibodies (bNAbs) 2F5 and 4E10 bind to the membrane proximal external region (MPER) of gp41 and also cross-react with phospholipids. In this study, we investigated if chemical modifications on the MPER adjacent to 2F5 and 4E10 epitopes
Vincent J Venditto et al.
Clinical and vaccine immunology : CVI, 20(1), 39-45 (2012-11-02)
The inability to generate broadly neutralizing antibody (bnAb) responses to the membrane proximal external region (MPER) of HIV-1 gp41 using current vaccine strategies has hampered efforts to prevent the spread of HIV. To address this challenge, we investigated a novel
Mark B Stoddard et al.
Clinical and vaccine immunology : CVI, 17(1), 98-107 (2009-11-20)
Bacterial endotoxin interacts with the human immune system via complex immunological pathways. The evaluation of endotoxicity is important in the development of safe vaccines and immunomodulatory therapeutics. The Limulus amebocyte lysate (LAL) assay is generally accepted by the FDA for
Douglas S Watson et al.
Clinical and vaccine immunology : CVI, 18(2), 289-297 (2010-12-17)
Particulate delivery systems enhance antibody responses to subunit antigens. However, covalent attachment of protein antigens can disrupt protein structure and mask critical epitopes, altering the antibody response to the antigen. In this report, we evaluate noncovalent metal chelation via nitrilotriacetic
Hong Zhao et al.
PLoS pathogens, 10(4), e1004009-e1004009 (2014-04-12)
Metarhizium robertsii is a plant root colonizing fungus that is also an insect pathogen. Its entomopathogenicity is a characteristic that was acquired during evolution from a plant endophyte ancestor. This transition provides a novel perspective on how new functional mechanisms
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.