H1007
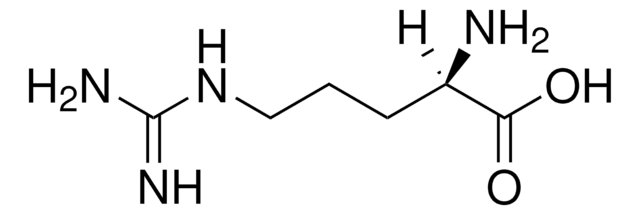
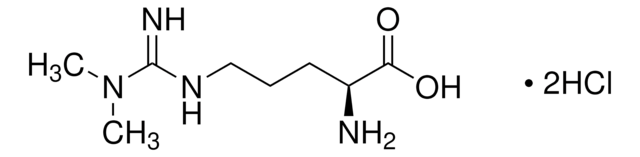
L-Homoarginin -hydrochlorid
≥98% (TLC)
Synonym(e):
(S)-2-Amino-6-guanidinhexansäure -hydrochlorid
About This Item
Empfohlene Produkte
product name
L-Homoarginin -hydrochlorid, unnatural arginine analog
Assay
≥98% (TLC)
Form
powder
Farbe
white to off-white
mp (Schmelzpunkt)
213-215 °C (lit.)
Löslichkeit
H2O: soluble
Anwendung(en)
peptide synthesis
SMILES String
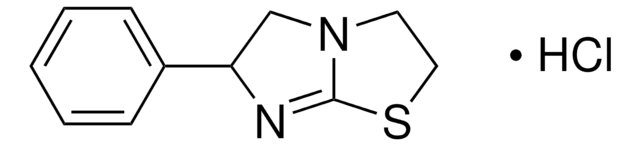
Cl[H].N[C@@H](CCCCNC(N)=N)C(O)=O
InChI
1S/C7H16N4O2.ClH/c8-5(6(12)13)3-1-2-4-11-7(9)10;/h5H,1-4,8H2,(H,12,13)(H4,9,10,11);1H/t5-;/m0./s1
InChIKey
YMKBVNVCKUYUDM-JEDNCBNOSA-N
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
Anwendung
Biochem./physiol. Wirkung
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 3
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Persönliche Schutzausrüstung
Eyeshields, Gloves, type N95 (US)
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.