Alle Fotos(1)
Wichtige Dokumente
EMS0004
SOLu-Trypsin
recombinant, expressed in Pichia pastoris, Proteomics Grade, liquid
Synonym(e):
Proteinaufschluss für die Massenspektrometrie, Trypsin für den Proteinaufschluss
Anmeldenzur Ansicht organisationsspezifischer und vertraglich vereinbarter Preise
Alle Fotos(1)
About This Item
UNSPSC-Code:
12352204
NACRES:
NA.78
Empfohlene Produkte
Verwandte Kategorien
Allgemeine Beschreibung
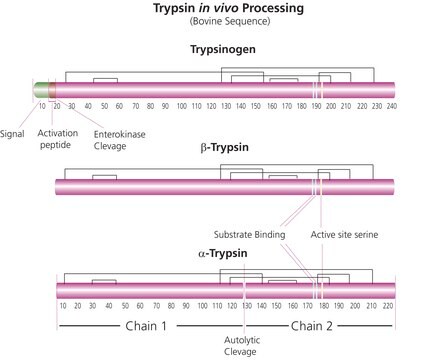
Trypsin ist eine Serinendoprotease des Pankreas. SOLu-Trypsin wird aus rekombinantem Trypsin, Schweinesequenz, hergestellt. Es weist keine chymotryptische Aktivität auf.
Anwendung
SOLu-Trypsin:
- wurde verwendet, um die Gelstücke für die Massenspektrometrie zur Identifizierung von aktiven Deubiquitinasen (DUB) aufzuschließen
- wurde als Puffer im Trypsin-Sensitivitätsassay eingesetzt
- kann zum Aufschluss von Weinproteinen eingesetzt werden
Biochem./physiol. Wirkung
Trypsin wird aufgrund seiner hochspezifischen Spaltung, die zu einer begrenzten Anzahl tryptischer Peptide führt, in der Proteomikforschung für Peptid-Mapping und Proteinsequenzarbeit eingesetzt. Es hydrolysiert Peptidbindungen an der Carboxylseite von Arginin- und Lysinresten spezifisch.
- SOLu-Trypsin (EMS0004) ist unser exklusives Enzym in fortgeschrittener Proteomikqualität für die Massenspektrometrie, das in Lösung stabil ist.
- SOLu-Trypsin wurde entwickelt, um gekühlt in Lösung stabil zu sein und kann ohne Aufbereitung umgehend verwendet werden.
- Andere Formen von Trypsin erfordern Auftauen oder Rekonstitution und müssen entsorgt werden, wenn sie nicht umgehend verwendet werden.
- SOLu-Trypsin ermöglicht das Aufbewahren von überschüssigem Produkt für künftige Anwendungen, wodurch unnötiger Abfall und Kosten eliminiert werden.
- Es wird mit hochreinem, rekombinantem Trypsin, das frei von chymotryptischer Aktivität ist formuliert, um einen Aufschluss mit hoher Genauigkeit sicherzustellen.
Leistungsmerkmale und Vorteile
- Gebrauchsfertig – keine Aufbereitung wie Rekonstitution oder Auftauen erforderlich
- Fügt sich nahtlos in den etablierten Arbeitsablauf – keine Notwendigkeit zum Ändern von Protokollen
- Eliminiert Abfall – bleibt nach Gebrauch im Kühlschrank stabil, wodurch kein überschüssiges Produkt entsorgt werden muss
- Rekombinant, Schweinesequenz – keine chymotryptische Aktivität
- Bei Raumtemperatur für den kurzzeitigen Gebrauch in einem Autosampler oder auf einem Liquid-Handling-Roboter stabil
Lagerklassenschlüssel
10 - Combustible liquids
WGK
WGK 1
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Hier finden Sie alle aktuellen Versionen:
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Enhanced trypsin on a budget: Stabilization, purification and high-temperature application of inexpensive commercial trypsin for proteomics applications
Heissel S, et al.
PLoS ONE, 14 (2019)
Søren Heissel et al.
PloS one, 14(6), e0218374-e0218374 (2019-06-28)
Trypsin is by far the most commonly used protease in proteomics. Even though the amount of protease used in each experiment is very small, digestion of large amounts of protein prior to enrichment can be rather costly. The price of
Zdeněk Perutka et al.
Journal of mass spectrometry : JMS, 55(7), e4444-e4444 (2019-10-12)
Cysteine protease from grapevine (Vitis vinifera) belongs to those resistant proteins, which survive the process of vinification and can therefore be detected as wine components. Its amino acid sequence shows a homology to other members of the papain family, but
Andrea Haag et al.
eLife, 9 (2020-02-14)
The intracellular trafficking of growth factor receptors determines the activity of their downstream signaling pathways. Here, we show that the putative HSP-90 co-chaperone CHP-1 acts as a regulator of EGFR trafficking in C. elegans. Loss of chp-1 causes the retention
Artikel
Evaluation of Recombinant, Chemically Treated Trypsin in Proteomics and Protein Characterization Assays
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.