17-10224
LentiBrite-GFP-p62-Biosensor, lentiviral
Synonym(e):
Sequestosome-1, Sequestosome, Ubiquitin-binding protein p62, EBI3-associated protein, p62
About This Item
Empfohlene Produkte
Hersteller/Markenname
Chemicon®
LentiBrite
Qualitätsniveau
Methode(n)
cell based assay: suitable
immunocytochemistry: suitable
immunofluorescence: suitable
transfection: suitable
UniProt-Hinterlegungsnummer
Nachweisverfahren
fluorometric
Versandbedingung
dry ice
Angaben zum Gen
human ... SQSTM1(8878)
Allgemeine Beschreibung
http://www.nature.com/app_notes/nmeth/2012/121007/pdf/an8620.pdf
(Hier klicken!)
Erfahren Sie mehr über die Vorteile unserer LentiBrite lentiviralen Biosensoren! Hier klicken
Biosensoren können zum Nachweis des Vorliegens/Fehlens eines bestimmten Proteins sowie des subzellulären Orts dieses Proteins im lebenden Zustand einer Zelle eingesetzt werden. Fluoreszenzmarkierungen sind oft das gewünschte Mittel zum Veranschaulichen des Proteins von Interesse in einer Zelle mittels Fluoreszenzmikroskopie oder Zeitraffer-Videoaufnahme. Das Veranschaulichen von lebenden Zellen ohne Störung ermöglicht es Forschenden die zellulären Bedingungen in Echtzeit zu sehen.
Lentivirale Vektorsysteme sind ein beliebtes Forschungswerkzeug zum Einbringen von Genprodukten in Zellen. Die lentivirale Transfektion bietet Vorteile gegenüber nichtviralen Verfahren wie einer Transfektion auf chemischer Basis, einschließlich die Transfektion von teilungsfähigen und nicht teilungsfähigen Zellen mit höherer Effizienz, der stabilen Langzeitexpression des Transgens und der geringen Immunogenität.
EMD Millipore stellt lentivirale LentiBrite-Biosensoren vor, eine neue Serie vorgepackter lentiviraler Partikel, die wichtige und grundlegende Proteine für Autophagie, Apoptose und Zellstruktur zur Veranschaulichung unter verschiedenen Zell-/Erkrankungszuständen in lebenden Zellen und in der In-vitro-Analyse kodieren.
- Vorgepackt, mit GFP & RFP fluoreszenzmarkiert
- Transfektion mit höherer Effizienz im Vergleich zu traditionellen Transfektionen auf chemischer Basis und anderen Transfektionsverfahren auf nicht-viraler Basis
- Fähigkeit zum Transfizieren von teilungsfähigen und nicht-teilungsfähigen Zellen sowie schwer zu transfizierenden Zelltypen wie Primärzellen und Stammzellen
- Stört die Zellfunktion nicht
Lentivirale LentiBrite-GFP-p62-Partikel von EMD Millipore bieten eine strahlende Fluoreszenz und präzise Lokalisierung, um die Lebendzellanalyse der Autophagie von schwer zu transfizierenden Zelltypen zu ermöglichen.
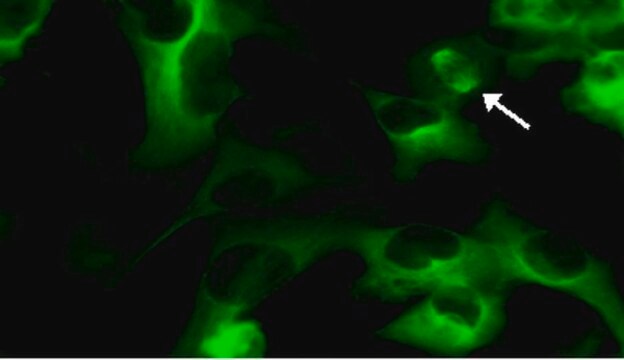
Anwendung
Bildgebung:
(Siehe Abbildung 1 im Datenblatt)
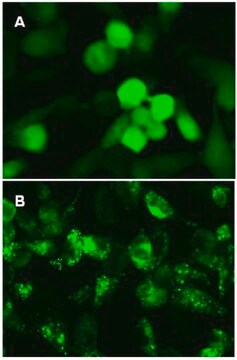
Die primären humanen mesenchymalen Stammzellen (HuMSC) wurden in Kammerobjektträgern ausplattiert und mit lentiviralen Partikeln mit einer MOI von 40 für 24 Stunden transduziert. Nach dem Austausch des Mediums und 24 Stunden weiterer Inkubation wurden die Zellen entweder in einem vollständigen Medium belassen oder 4 Stunden lang in einem EBSS mit einem Lysososomen-Inhibitor inkubiert, um die Bildung von Autophagosomen zu induzieren und den lysosomalen Abbau zu hemmen. Die Zellen wurden mit Formaldehyd fixiert, aufgebracht und mittels Ölimmersion-Weitfeld-Fluoreszenzmikroskopie abgebildet.
Das GFP-p62 zeigt eine diffuse zytosolische Verteilung in den Fed-Zellen und eine punktförmige Verteilung in ausgehungerten autophagischen Zellen.
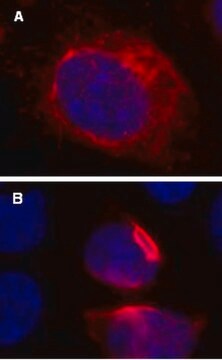
Immunzytochemischer Vergleich:
(Siehe Abbildung 2 im Datenblatt)
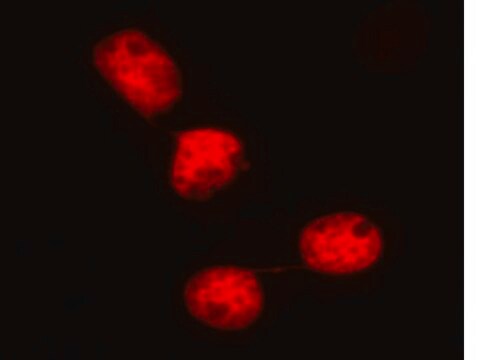
Ähnlich wie für Abbildung 1 (siehe Datenblatt) wurden U2OS-Zellen auf einem Kammerobjektträger ausplattiert und mit lentiviralen GFP-p62-Partikeln mit einer MOI von 40 für 24 Stunden transduziert. Nach 24 Stunden wurde das Medium ausgetauscht und die Zellen wurden für weitere 24 Stunden inkubiert. Anschließend wurden die Zellen fixiert und mit einem polyklonalen Antikörper gegen p62 (Art.-Nr. MABC32), gefolgt von einem Cy3-konjugierten Anti-Kaninchen-IgG gefärbt. Die Verteilung des GFP-p62 (grün) ähnelt der Verteilung beim Nachweis durch die immunzytochemische Färbung (rot).
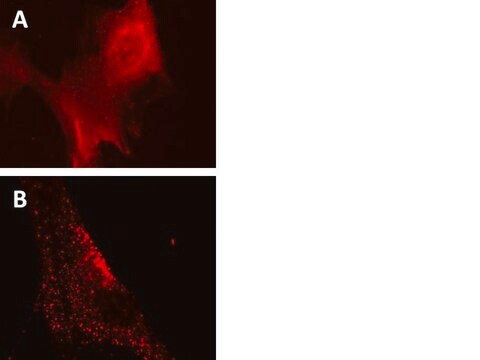
Schwer zu transfizierende Zelltypen:
(Siehe Abbildung 3 im Datenblatt)
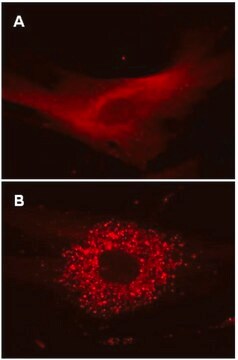
Primäre HUVEC-Zelltypen wurden auf einem Kammerobjektträger ausplattiert und mit lentiviralen Partikeln mit einer MOI von 40 für 24 Stunden transduziert. Nachfolgende Behandlungen für Zellen, die in vollständigen Medien belassen oder in EBSS mit Lysososomen-Inhibitoren inkubiert wurden, wurden wie in den Abbildungen 1A und 1B (siehe Datenblatt) durchgeführt.
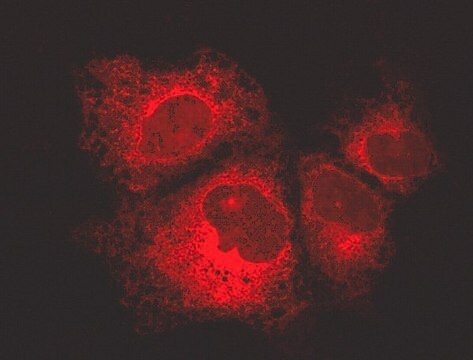
Zeitrafferbildgebung:
(Siehe Abbildung 5 im Datenblatt und im Video online)
U2OS-Zellen wurden in Deckglas-Kammerobjektträgern plattiert und mit lentiviralen GFP-p62-Partikeln wie in Abbildung 1 (siehe Datenblatt) transduziert. Die Bilder wurden insgesamt 32 Minuten lang alle 20 Sekunden aufgenommen. Hier sehen Sie 3 aufeinanderfolgende Bilder. Das GFP-p62 zeigt eine diffuse zytosolische Verteilung in Fed-Zellen und eine punktförmige Verteilung in ausgehungerten autophagischen Zellen.
Für eine optimale fluoreszente Veranschaulichung wird empfohlen, die Zielexpressionswerte innerhalb von 24-48 Stunden nach der Transfektion/Infektion zu analysieren, um eine optimale Lebendzellanalyse zu erhalten, da die Fluoreszenzintensität mit der Zeit schwächer werden kann, insbesondere in schwer zu transfizierenden Zelllinien. Infizierte Zellen können nach einer erfolgreichen Transfektion/Infektion eingefroren und in Kultur aufgetaut werden, um die positive Fluoreszenzexpression länger als 24–48 Stunden zu erhalten. Die Länge und Intensität der Fluoreszenzexpression variiert zwischen den Zelllinien. Für schwer zu transfizierende Zelllinien können höhere MOI erforderlich sein.
Apoptose & Krebs
Neurowissenschaft
Apoptose – Weitere
Neurodegenerative Erkrankungen
Komponenten
Ein Fläschchen mit 25 µl lentiviralen Partikeln mit mindestens 3 x 10E8 infektiösen Einheiten je ml.
Chargenspezifische Titer-Informationen entnehmen Sie bitte dem chargenspezifischen “Virustiter” in den Produktspezifikationen des Datenblatts.
Promotor
EF-1 (Elongation Factor-1)
Multiplizität der Infektion (MOI)
MOI = Verhältnis der Anzahl von infektiösen lentiviralen Partikeln zu der Anzahl von infizierten Zellen.
Typische MOI-Werte für eine hohe Transduktionseffizienz und Signalintensität liegen im Bereich von 20–40. Für dieses Ziel können einige Zelltypen geringere MOI erfordern (z. B. HT-1080, HeLa, U2OS, humane mesenchymale Stammzellen (HuMSC)), während andere höhere MOI erfordern können (z. B. endotheliale Zellen der humanen Nabelschnur (HUVEC)).
HINWEIS: Die MOI sollte vom Anwender für jeden Zelltyp und jedes lentivirale Ziel titriert und optimiert werden, um die gewünschte Transduktionseffizienz und Signalintensität zu erreichen.
Qualität
Physikalische Form
Lagerung und Haltbarkeit
Lentivirus ist ab Empfangsdatum mindestens 4 Monate haltbar, wenn es bei -80 °C gelagert wird. Nach dem ersten Auftauen sofort auf Eis geben und in Arbeitsaliquoten bei -80 °C einfrieren. Gefrorene Aliquote können mindestens 2 Monate gelagert werden. Weiteres Einfrieren/Auftauen kann zu einem verringerten Virustiter und einer geringeren Transduktionseffizienz führen.
WICHTIGER SICHERHEITSHINWEIS
Replikationsdefiziente lentivirale Vektoren wie der in diesem Produkt gelieferte Vektor der 3. Generation verursachen bei Mensch oder Tier bekanntermaßen keine Erkrankungen. Lentiviren können jedoch in das Genom der Wirtszelle eindringen und bergen somit ein gewisses Risiko für Insertionsmutagenesen. Das Material gehört zur Risikogruppe 2 und die Handhabung sollte unter BSL2-Kontrollen erfolgen. Eine detaillierte Erörterung der Biosicherheit von lentiviralen Vektoren finden Sie in Pauwels, K. et al. (2009). State-of-the-art lentiviral vectors for research use: Risk assessment and biosafety recommendations. Curr. Gene Ther. 9: 459-474.
Rechtliche Hinweise
Lagerklassenschlüssel
10 - Combustible liquids
WGK
WGK 2
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.