Síntesis peptídica
Un péptido consta de dos o más aminoácidos unidos por un enlace amida para formar una cadena de aminoácidos normalmente de 2 a 70 aminoácidos de longitud. Los péptidos se distinguen de las proteínas por no tener que plegarse para exhibir actividad biológica. Los péptidos aparecen endógenamente como hormonas peptídicas, como la angiotensina, la LHRH y la encefalina, y como toxinas en plantas y animales. Los péptidos son de gran interés como prototipos moleculares para el descubrimiento de medicamentos y como fármacos por derecho propio. También encuentran su aplicación en vacunas, biomateriales y sondas histológicas, y se utilizan en gran cantidad como antígenos para generar anticuerpos.
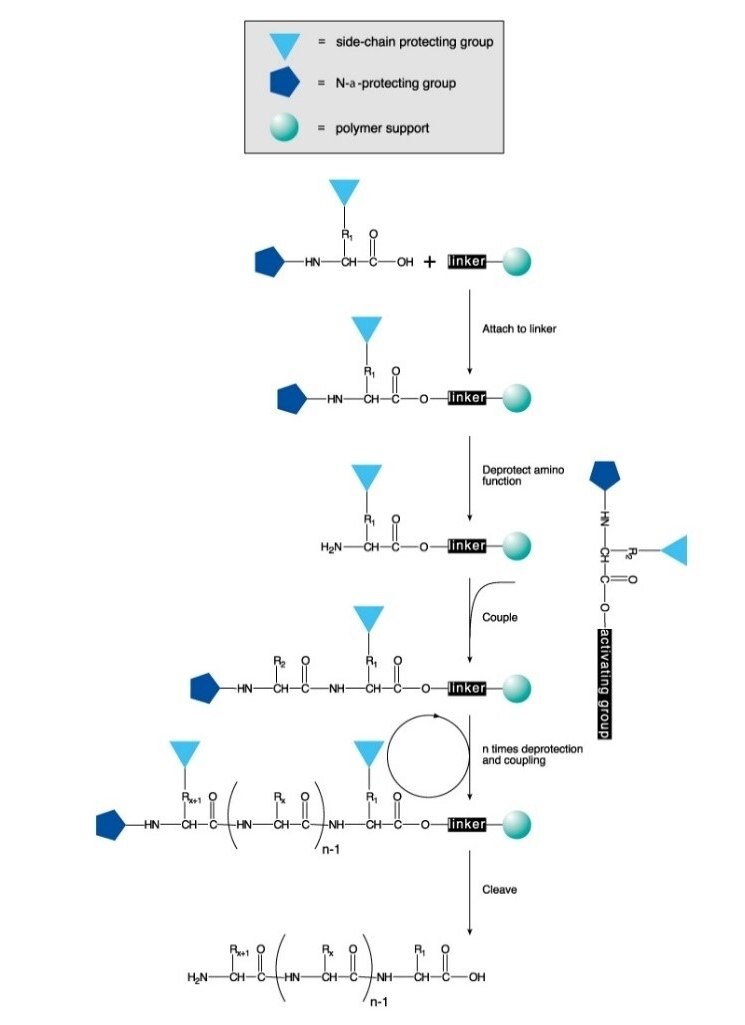
Los péptidos se sintetizan químicamente en disolución o en una fase sólida. El proceso implica la formación dirigida y selectiva de un enlace amida entre un aminoácido protegido en el extremo N y un aminoácido que contenga un grupo amino libre y un ácido carboxílico protegido. En la síntesis en fase sólida, el grupo protector del carboxilo está unido a un soporte polimérico. Después de la formación del enlace, se elimina del dipéptido el grupo protector del amino y se conecta el siguiente aminoácido protegido en N.
Artículos técnicos relacionados
- Fmoc resin cleavage and deprotection follows the difficult task of detaching the peptide from the resin support and removing all the side-chain protecting groups of the amino acid residues to yield the desired peptide.
- Novabiochem® offers a large number of coupling reagents for in situ activation. In situ activating reagents are easy to use, fast reacting – even with sterically hindered amino acids, and their use is generally free of side reactions.
- Review methods and resins for attaching amino acids and peptides, including Merrifield, trityl-based, and hydroxymethyl-functionalized resins. Resin-immobilized peptides can be used for various downstream applications.
- COMU is a non-explosive coupling agent suitable for solution phase & solid phase peptide synthesis. Its activity meets or exceeds that of HATU and its water-soluble by-product are easily removed.
- In principle, the seemingly simple formation of a peptide bond can be accomplished using all the procedures available in organic chemistry for the synthesis of carboxylic acid amides. However, due to the presence of various functional groups in natural and unnatural amino acids and particularly the requirement for full retention of chiral integrity, the coupling of amino acids and peptides under mild conditions can be challenging. A plethora of coupling reagents has been developed superseding each other in efficiency and suitability for specific applications (e.g., solid-phase peptide synthesis or fragment condensation).
- Ver todo (22)
Protocolos relacionados
- A guide to create solvent systems used for the thin-layer chromatography assay of Novabiochem products.
- Overcome challenges in synthesis and disulfide bond formation with protocols for Fmoc solid-phase peptide synthesis of peptides with cysteine and methionine.
- Amide Coupling in a Box
- Information on the Amide bond and the Catalytic Amide Bond Formation Protocol. Amidation of amines and alcohols. The amide bond, an important linkage in organic chemistry, is a key functional group in peptides, polymers, and many natural products and pharmaceuticals.
- We provide an overview of our available reagents, together with recommendations and details of their use for synthesis of peptides containing post-translationally modified amino acids.
- Ver todo (10)

Figura 2Grupos protectores de cadena lateral para la síntesis peptídica en fase sólida (SPPS) Boc
La síntesis peptídica en fase sólida (SSPS) es el método más utilizado de síntesis de péptidos debido a su eficiencia, simplicidad, velocidad y facilidad de paralelización. La SPPS consiste en la adición secuencial de restos de aminoácido protegidos en el grupo amino y en la cadena lateral a un aminoácido o péptido unido a un soporte polimérico insoluble (Figura 1).
Para la protección del N-α pueden utilizarse o bien un grupo Boc sensible a ácidos (SPPS Boc) o bien un grupo Fmoc sensible a bases (SPPS Fmoc). Después de la eliminación de este grupo protector, se añade el siguiente aminoácido protegido utilizando un reactivo de acoplamiento o un derivado aminoácido protegido preactivado. El aminoácido C-terminal se ancla a la resina a través de un enlazador, cuya naturaleza determina las condiciones requeridas para liberar el péptido del soporte después de la extensión de la cadena. Se suelen elegir grupos protectores de cadena lateral para que se separen simultáneamente con el desprendimiento del péptido de la resina (Figuras 2 y 3).

Figura 3.Grupos protectores de cadena lateral para la síntesis peptídica en fase sólida (SPPS) Fmoc
La mayoría de los péptidos se preparan mediante el método Fmoc, ya que la separación y la desprotección finales se llevan a cabo mediante el tratamiento con ácido trifluoroacético en oposición al método Boc, que requiere el uso del muy tóxico y corrosivo HF anhidro líquido en equipos especializados.
Pueden prepararse de manera sistemática péptidos de 50 aminoácidos, aunque es habitual que se comuniquen síntesis de proteínas de más de 100 aminoácidos. Pueden fabricarse proteínas más largas mediante la ligadura química nativa de péptidos completamente desprotegidos en disolución. Con este método, es posible sintetizar péptidos naturales que son difíciles de expresar en bacterias, incorporar aminoácidos no naturales o D-aminoácidos y generar péptidos cíclicos, ramificados, marcados y modificados después de la traducción.
La síntesis de péptidos en fase líquida, que normalmente utiliza la protección Boc o Z-amino, ha sido sustituida por la síntesis de péptidos en fase sólida, excepto para los procesos existentes de síntesis de péptidos a gran escala con fines industriales.
Para seguir leyendo, inicie sesión o cree una cuenta.
¿No tiene una cuenta?