ELISA 프로토콜
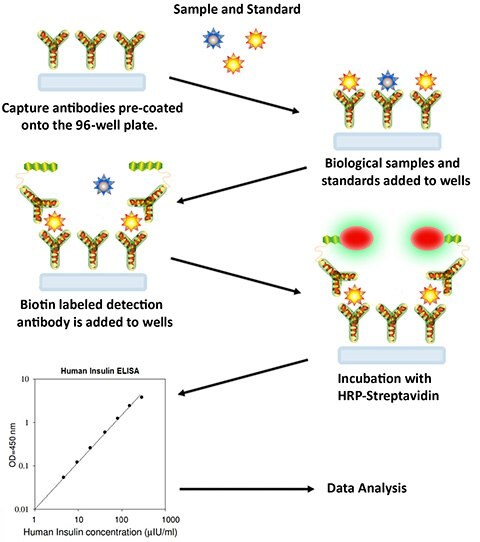
샌드위치 분석법
- 사용 이전에 모든 시약 및 시료가 실온(18-25 °C)이 되도록 하십시오. 모든 표준 물질과 시료에 대해 최소한 두 번 반복 수행할 것을 권장합니다.
- 각 표준 물질 및 시료 100 µL를 전용 웰에 추가합니다. 웰을 덮개로 덮고 실온에서 2시간 30분 동안 배양하거나 약하게 흔들면서 4 °C에서 밤새 배양합니다.
- 용액을 폐기하고 1X 세척 용액을 사용하여 4번 세척합니다. 멀티채널 피펫이나 자동 세척기를 사용하여 워시 버퍼(300 µL)로 모든 웰을 가득 채우는 방식으로 세척하십시오. 양호한 성능을 얻으려면 각 단계에서 용액을 완전히 제거하는 것이 가장 중요합니다. 마지막 세척 이후 남은 모든 워시 버퍼를 흡입기를 사용하거나 다른 용기에 옮겨 부어 제거합니다. 플레이트를 뒤집고 깨끗한 종이 수건으로 닦아냅니다.
- 같은 배율로 조제된 검출용 항체 100 µL를 각 웰에 추가합니다. 웰을 덮개로 덮고 실온에서 1시간 동안 약하게 흔들면서 배양합니다.
- 용액을 폐기합니다. 3단계와 동일하게 세척 절차를 반복합니다.
- 준비된 스트렙타아비딘 용액 100 µL를 각 웰에 추가합니다. 웰을 덮개로 덮고 실온에서 45분 동안 약하게 흔들면서 배양합니다.
- 용액을 폐기합니다. 3단계와 동일하게 세척을 반복합니다.
- TMB 원스텝 기질 시약(품목 H) 100 µL를 각 웰에 추가합니다. 웰을 덮개로 덮고 실온에서 빛을 차단한 상태로 30분 동안 약하게 흔들면서 배양합니다.
- 반응 정지액(항목 I) 50 µL를 각 웰에 추가합니다. 450 nm의 흡광도에서 즉시 판독합니다.
인산화 분석법
- 사용 이전에 모든 시약이 실온(18-25 °C)이 되도록 하십시오. 모든 시료 또는 양성 대조에 대해 최소한 두 번 반복 수행할 것을 권장합니다.
- 100 µL의 각 시료 또는 양성 대조를 전용 웰에 추가합니다. 플레이트 홀더로 웰을 덮고 실온에서 2시간 30분 동안 배양하거나 4 °C에서 밤새 흔들어 배양합니다.
- 용액을 폐기하고 1X 세척 용액을 사용하여 4번 세척합니다. 멀티채널 피펫이나 자동 세척기를 사용하여 워시 버퍼(300 µL)로 모든 웰을 가득 채우는 방식으로 세척하십시오. 양호한 성능을 얻으려면 각 단계에서 용액을 완전히 제거하는 것이 가장 중요합니다. 마지막 세척 이후 남은 모든 워시 버퍼를 흡입기로 제거합니다. 플레이트를 뒤집고 깨끗한 종이 수건으로 닦아냅니다.
- 준비된 1X 비오티닐레이트 항 포스포타이로신 항체 100 µL를 각 웰에 추가합니다. 실온에서 1시간 동안 흔들어 배양합니다.
- 용액을 폐기합니다. 3단계와 동일하게 세척을 반복합니다.
- 준비된 1X HRP-스트렙타아비딘 용액 100 µL를 각 웰에 추가합니다(시약 제조 6단계 참조). 실온에서 45분 동안 흔들어 배양합니다.
- 용액을 폐기합니다. 3단계와 동일하게 세척을 반복합니다.
- TMB 원스텝 기질 시약(품목 H) 100 µL를 각 웰에 추가합니다. 실온에서 빛을 차단한 상태로 30분 동안 흔들어 배양합니다.
- 반응 정지액(항목 I) 50 µL를 각 웰에 추가합니다. 450 nm에서 즉시 판독합니다.

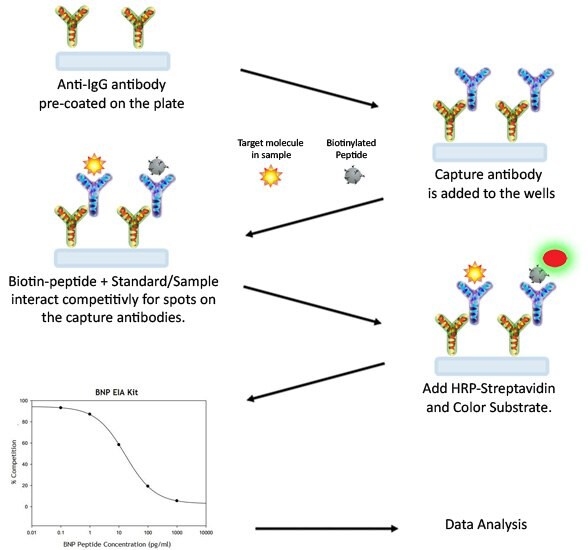
EIA 분석법
- 시약 제조 단계에서는 키트 시약을 얼음 위에 보관하십시오. 모든 표준 물질과 시료에 대해 최소한 두 번 반복 수행할 것을 권장합니다.
- 항 “표적” 항체 100 µL를 각 웰에 추가합니다. 실온에서 1.5시간 동안 약하게 흔들어(초당 1-2바퀴) 배양합니다. 또한 4 °C에서 밤새 배양할 수도 있습니다.
- 용액을 폐기하고 멀티채널 피펫이나 자동 플레이트 세척기를 사용하여 1X 세척 용액(각 200-300 μl)으로 4번 세척합니다. 양호한 분석 결과를 얻으려면 각 단계에서 용액을 완전히 제거하는 것이 가장 중요합니다. 마지막 세척 이후 남은 모든 워시 버퍼를 흡입기를 사용하거나 다른 용기에 옮겨 부어 제거합니다. 플레이트를 뒤집고 깨끗한 종이 수건으로 닦아냅니다.
- 각 표준 물질, 양성 대조 및 시료 100 µL를 전용 웰에 추가합니다. 웰 하나는 빈 것으로 남겨둡니다(분석 희석용). 웰을 덮개로 덮고 실온에서 2.5시간 동안 약하게 흔들어(초당 1-2바퀴) 배양하거나 4 °C에서 밤새 배양합니다.
- 용액을 폐기하고 3단계에서 설명한 대로 4번 세척합니다.
- 준비된 HRP-스트렙타아비딘 용액 100 µL를 각 웰에 추가합니다. 실온에서 45분 동안 약하게 흔들어 배양합니다. 배양 시간은 정확하게 45분을 지킬 것을 권장합니다.
- 용액을 폐기하고 3단계에서 설명한 대로 4번 세척합니다.
- TMB 원스텝 기질 시약(품목 H) 100 µL를 각 웰에 추가합니다. 실온에서 빛을 차단한 상태로 30분 동안 약하게 흔들어주면서(초당 1-2번) 배양합니다.
- 반응 정지액(항목 I) 50 µL를 각 웰에 추가합니다. 450 nm의 흡광도에서 즉시 판독합니다.
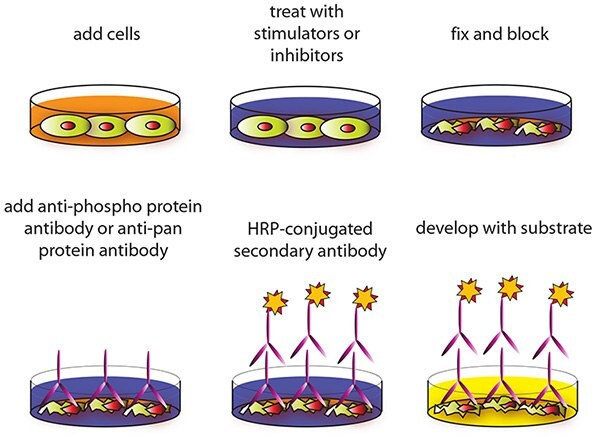
세포 기반 분석법
참고:모든 배양 및 세척 단계는 약하게 흔들거나 회전하는 조건으로 실시해야 합니다(초당 1-2바퀴).
- 아래와 같이 실험 방법을 설계합니다.
옵션: HUVECs, HMEC‐1 또는 기타 느슨하게 부착된 세포를 살포하는 경우 100 μL의 폴리라이신(Sigma-Aldrich Product No. P4832 권장)을 각 웰에 첨가하는 방식으로 Uncoated 96‐Well 마이크로 플레이트(ITEM A)를 코팅한 다음 제조사의 설명서를 따릅니다. 프리코트 CellBIND® 마이크로 플레이트 또는 기타 폴리라이신 처리된 조직 배양 플레이트를 ITEM A 대신에 사용할 수 있습니다. - 준비된 Uncoated 96‐Well 마이크로 플레이트(ITEM A)의 각 웰에 10,000-30,000개 세포에 해당하는 100 μL를 파종하고 37 °C에서 5 % CO2로 밤새 배양합니다.
참고: 사용된 최적의 세포 수는 세포 라인 및 단백질 인산화물의 상대적인 양에 따라 다릅니다. 세포 수를 초과하여 또는 부족하게 사용할 수 있으나 이는 경험적으로 결정해야 합니다. 참고: 억제제 또는 활성제로 처리하기 전에 셀 라인에 따라 4-24시간까지 세포를 굶주리게 할 수 있습니다. - 제조사의 지침에 따라 다양한 치료제, 억제제(예: siRNA 또는 화학제 등) 또는 활성제를 적용하고 원하는 시간만큼 배양합니다.
참고: 제조사의 설명서에 달리 명시하지 않은 한 세포를 처리하기 전에 혈청이 포함되지 않은 세포 배양 배지에 억제제 또는 활성제를 용해하는 것이 좋습니다. - 마이크로 플레이트를 뒤집어 세포 배양 배지를 버리고 개수대 위에서 마이크로 플레이트 바닥면을 가볍게 두드립니다.
- 준비된 1X 워시 버퍼 A(ITEM B) 200 µL를 각 웰에 피펫팅하여 세척합니다. 워시 버퍼를 버리고(4단계와 동일) 매번 새로운 워시 버퍼로 두 번 더 세척하여 총 3회 세척합니다. 마지막 세척 이후 종이 타월로 마이크로 플레이트를 부드럽게 닦아 여분의/남겨진 버퍼를 제거합니다.
참고: 세포 손실을 막기 위해서는 세포에 직접 피펫팅하지 마십시오. 대신에 세포 배양 웰의 벽을 따라 용액을 조금씩 분배합니다. 또한 용액을 버릴 때 진공 흡입기를 사용하거나 마이크로 플레이트를 너무 세게 두드리지 마십시오. - 정착액(ITEM D) 100 µL를 각 웰에 추가하고 실온에서 20분 동안 배양합니다.
참고: 정착액은 세포에 침투하는데 사용됩니다. - 5단계와 동일하게 세척을 반복합니다.
- 준비된 1X 퀜칭 버퍼(ITEM E) 200 µL를 각 웰에 추가하고 실온에서 20분 동안 배양합니다.
참고: 퀜칭 버퍼는 백그라운드 반응을 최소화하는 데 사용됩니다. - 1X 워시 버퍼 A를 사용하여 4번 세척합니다.
- 준비된 1X 블로킹 버퍼(ITEM F) 200 µL를 각 웰에 추가하고 37 °C에서 1시간 동안 배양합니다.
- 준비된 1X 워시 버퍼 B(ITEM C)를 사용하여 3번 세척합니다.
참고: 필요한 경우 세척 이후 마이크로 플레이트를 80 °C에서 보관할 수 있습니다. - 준비된 1X 1차 항체(ITEM G‐1, G‐2, G‐3, H‐ 1, H‐2 또는 H‐3) 50 µL를 각 해당 웰에 추가하고 실온에서 2시간 동안 배양합니다.
- 1X 워시 버퍼 B를 사용하여 4번 세척합니다.
- 준비된 HRP 결합형 2차 항체(ITEM I‐2) 50 µL를 각 웰에 추가하고 실온에서 1시간 동안 배양합니다.
- 13단계를 반복합니다.
- TMB 기질 100 μL를 각 웰에 추가하고 실온에서 빛을 차단한 상태로 30분 동안 배양합니다.
- 반응 정지액(ITEM K) 50 µL를 각 웰에 추가합니다. 450 nm에서 즉시 판독합니다.
이 프로토콜은 지침으로만 사용됩니다. 자세한 지침은 각 키트에 대한 세부 기술 공고를 참조하십시오.
계속하려면 로그인하세요.
계속 읽으시려면 로그인하거나 계정을 생성하세요.
계정이 없으십니까?