62970
Lisozima
dialyzed, lyophilized, powder, ~100000 U/mg
Sinonimo/i:
Mucopeptide N-acetilmuramoil idrolasi, Muramidasi
About This Item
Prodotti consigliati
Origine biologica
chicken egg white
Livello qualitativo
Stato
powder
Qualità
dialyzed
lyophilized
Attività specifica
~100000 U/mg
PM
single-chain 14.3 kDa
Mr ~14600
tecniche
cell based assay: suitable
Compatibilità
suitable for cell lysis
N° accesso UniProt
applicazioni
cell analysis
Temperatura di conservazione
2-8°C
Informazioni sul gene
chicken ... LYZ(396218)
Cerchi prodotti simili? Visita Guida al confronto tra prodotti
Applicazioni
- come standard in esperimenti di diffusione di neutroni a piccolo angolo e spettroscopia infrarossa in assorbanza
- come costituente di tampone per lisi cellulare
- in esperimenti di cristallizzazione delle proteine
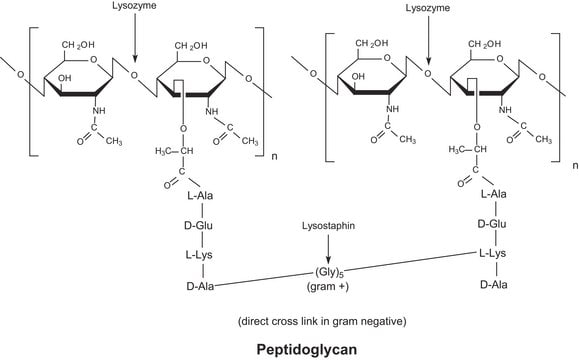
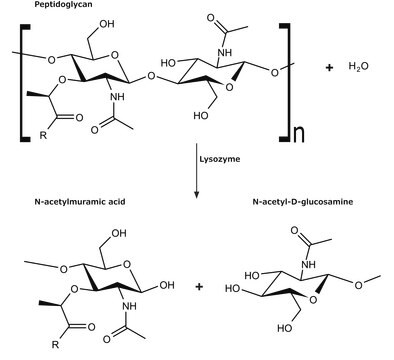
Azioni biochim/fisiol
L'enzima è attivo in un ampio intervallo di pH (da 6,0 a 9,0). A pH 6,2, l'attività massima si osserva su una gamma più ampia di forze ioniche (da 0,02 a 0,100 M) rispetto a pH 9,2 (da 0,01 a 0,06 M).
Definizione di unità
Altre note
Avvertenze
Danger
Indicazioni di pericolo
Consigli di prudenza
Classi di pericolo
Resp. Sens. 1
Codice della classe di stoccaggio
11 - Combustible Solids
Classe di pericolosità dell'acqua (WGK)
WGK 3
Punto d’infiammabilità (°F)
Not applicable
Punto d’infiammabilità (°C)
Not applicable
Dispositivi di protezione individuale
Eyeshields, Gloves, type N95 (US)
Scegli una delle versioni più recenti:
Certificati d'analisi (COA)
Non trovi la versione di tuo interesse?
Se hai bisogno di una versione specifica, puoi cercare il certificato tramite il numero di lotto.
Possiedi già questo prodotto?
I documenti relativi ai prodotti acquistati recentemente sono disponibili nell’Archivio dei documenti.
I clienti hanno visto anche
Articoli
Separation of Ribonuclease A from bovine pancreas, Type I-A, powder, ≥60% RNase A basis (SDS-PAGE), ≥50 Kunitz units/mg protein; α-Chymotrypsinogen A from bovine pancreas, essentially salt-free, lyophilized powder; Cytochrome c from bovine heart, ≥95% based on Mol. Wt. 12,327 basis; Lysozyme from chicken egg white, lyophilized powder, protein ≥90 %, ≥40,000 units/mg protein
Separation of Ribonuclease A from bovine pancreas, Type I-A, powder, ≥60% RNase A basis (SDS-PAGE), ≥50 Kunitz units/mg protein; α-Chymotrypsinogen A from bovine pancreas, essentially salt-free, lyophilized powder; Cytochrome c from bovine heart, ≥95% based on Mol. Wt. 12,327 basis; Lysozyme from chicken egg white, lyophilized powder, protein ≥90 %, ≥40,000 units/mg protein
Il team dei nostri ricercatori vanta grande esperienza in tutte le aree della ricerca quali Life Science, scienza dei materiali, sintesi chimica, cromatografia, discipline analitiche, ecc..
Contatta l'Assistenza Tecnica.