Synthèse peptidique
Un peptide comprend au moins deux acides aminés liés par une liaison amide, formant une chaîne d'acides aminés faisant généralement 2 à 70 acides aminés de long. Les peptides se distinguent des protéines dans le sens où ils n'ont pas besoin d'être repliés pour présenter une activité biologique. Chez les plantes et les animaux, les peptides endogènes peuvent être des hormones peptidiques, telles que l'angiotensine, la LH-RH et l'enképhaline, et des toxines. Les peptides présentent un grand intérêt en tant que composés tête de série (leads) pour la découverte de médicaments et en tant que médicaments à part entière. Ils ont également des applications dans les vaccins, les biomatériaux, les sondes histologiques, et sont utilisés en grands nombres comme antigènes pour générer des anticorps.
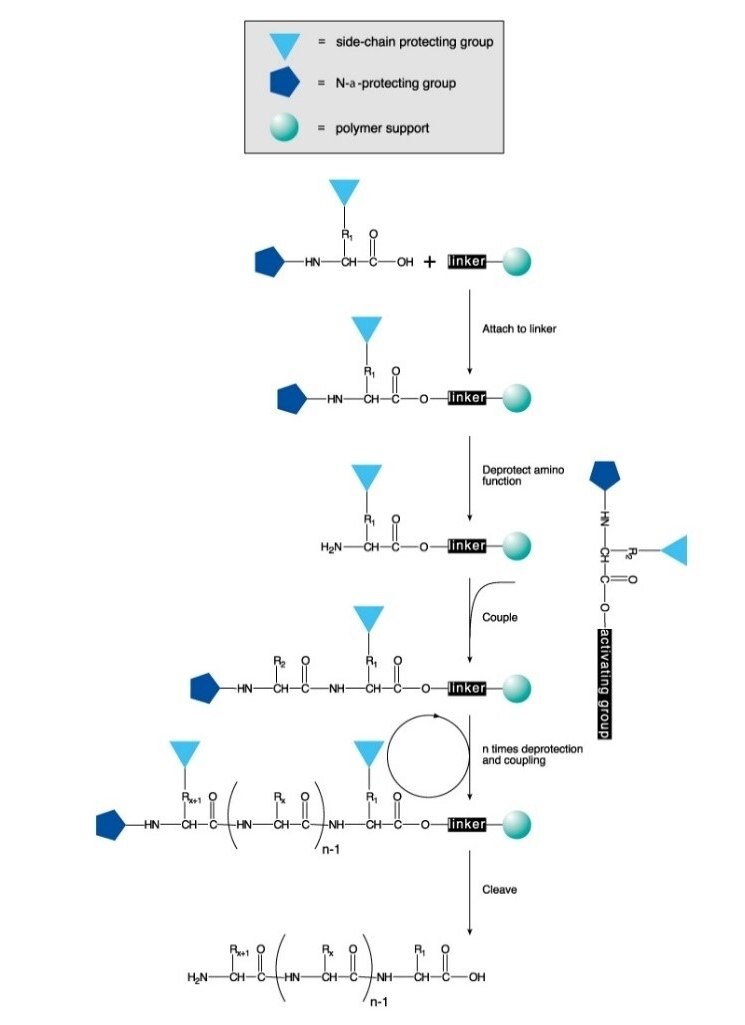
La synthèse chimique des peptides se fait en solution ou sur une phase solide. Le procédé consiste à former, de manière dirigée et sélective, une liaison amide entre un acide aminé N-protégé et un acide aminé portant un groupement amino libre et un groupement carboxyle protégé. En synthèse en phase solide, le groupement de protection du carboxyle est lié à un support polymère. Après formation de la liaison, le groupement de protection de la fonction amino du peptide est retiré, et l'acide aminé N-protégé suivant est couplé.
Articles techniques apparentés
- Fmoc resin cleavage and deprotection follows the difficult task of detaching the peptide from the resin support and removing all the side-chain protecting groups of the amino acid residues to yield the desired peptide.
- Novabiochem® offers a large number of coupling reagents for in situ activation. In situ activating reagents are easy to use, fast reacting – even with sterically hindered amino acids, and their use is generally free of side reactions.
- Review methods and resins for attaching amino acids and peptides, including Merrifield, trityl-based, and hydroxymethyl-functionalized resins. Resin-immobilized peptides can be used for various downstream applications.
- COMU is a non-explosive coupling agent suitable for solution phase & solid phase peptide synthesis. Its activity meets or exceeds that of HATU and its water-soluble by-product are easily removed.
- In principle, the seemingly simple formation of a peptide bond can be accomplished using all the procedures available in organic chemistry for the synthesis of carboxylic acid amides. However, due to the presence of various functional groups in natural and unnatural amino acids and particularly the requirement for full retention of chiral integrity, the coupling of amino acids and peptides under mild conditions can be challenging. A plethora of coupling reagents has been developed superseding each other in efficiency and suitability for specific applications (e.g., solid-phase peptide synthesis or fragment condensation).
- Afficher tout (22)
Protocoles apparentés
- A guide to create solvent systems used for the thin-layer chromatography assay of Novabiochem products.
- Overcome challenges in synthesis and disulfide bond formation with protocols for Fmoc solid-phase peptide synthesis of peptides with cysteine and methionine.
- Amide Coupling in a Box
- Information on the Amide bond and the Catalytic Amide Bond Formation Protocol. Amidation of amines and alcohols. The amide bond, an important linkage in organic chemistry, is a key functional group in peptides, polymers, and many natural products and pharmaceuticals.
- We provide an overview of our available reagents, together with recommendations and details of their use for synthesis of peptides containing post-translationally modified amino acids.
- Afficher tout (10)

Figure 2Groupements de protection des chaînes latérales pour la synthèse peptidique en phase solide (SPPS) du type Boc
La synthèse peptidique en phase solide (SPPS) est la méthode la plus fréquemment employée pour synthétiser des peptides, du fait de son efficacité, de sa simplicité, de sa rapidité et de sa facilité de parallélisation. La SPPS consiste à ajouter successivement, à un acide aminé ou un peptide fixé sur un support polymère insoluble, des résidus d'acides aminés à chaînes latérales et fonctions amino protégées (Figure 1).
Un groupement Boc labile en milieu acide (SPSS-Boc) ou un groupement Fmoc labile en milieu basique (SPPS-Fmoc) est utilisé pour la N-α-protection. Après retrait de ce groupement protecteur, l'acide aminé protégé suivant est ajouté à l'aide d'un réactif de couplage ou d'un dérivé d'acide aminé protégé pré-activé. L'acide aminé C-terminal est ancré dans la résine via un segment de liaison, dont la nature détermine les conditions requises pour libérer le peptide du support après allongement de la chaîne. Les groupements de protection des chaînes latérales sont souvent choisis de façon à être clivés simultanément avec détachement du peptide de la résine (Figures 2 et 3).

Figure 3.Groupements de protection des chaînes latérales pour la synthèse peptidique en phase solide (SPPS) du type Fmoc
La plupart des peptides sont préparés selon la méthode Fmoc, car le clivage et la déprotection finaux sont assurés par un traitement à l'acide trifluoroacétique, contrairement à la méthode Boc qui requiert du HF anhydre liquide, corrosif et extrêmement toxique, et du matériel spécialisé.
Il est possible de synthétiser en routine des peptides de 50 acides aminés ; des synthèses de protéines de plus de 100 acides aminés sont même régulièrement rapportées. Les protéines plus longues peuvent être fabriquées par ligation chimique native de peptides entièrement déprotégés en solution. Cette méthode permet de synthétiser des peptides naturels qui sont difficiles à exprimer dans les bactéries, d'incorporer des acides aminés D ou des acides non naturels, et de générer des peptides cycliques, ramifiés, marqués ou modifiés au stade post-traductionnel.
La synthèse peptidique en phase liquide, utilisant habituellement une protection Boc ou Z pour la fonction amino, a été remplacée par la synthèse peptidique en phase solide, hormis pour les procédés existants de synthèse à grande échelle de peptides à des fins industrielles.
Pour continuer à lire, veuillez vous connecter à votre compte ou en créer un.
Vous n'avez pas de compte ?