C8649
Cholesterin-Oxidase aus Streptomyces sp.
lyophilized powder, ≥20 units/mg protein
Synonym(e):
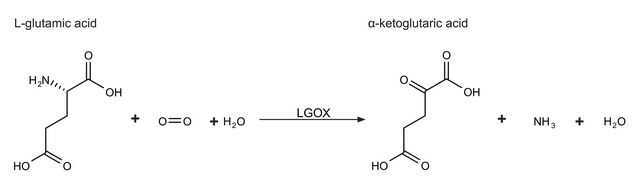
Cholesterin:Sauerstoff-Oxidoreduktase
About This Item
Empfohlene Produkte
Biologische Quelle
Streptomyces sp.
Qualitätsniveau
Form
lyophilized powder
Spezifische Aktivität
≥20 units/mg protein
Mol-Gew.
~34 kDa
Zusammensetzung
protein, 55-65% biuret
Löslichkeit
50 mM potassium phosphate buffer, pH 7.0: soluble (Cold)
Versandbedingung
dry ice
Lagertemp.
−20°C
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
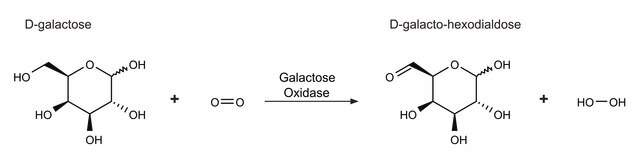
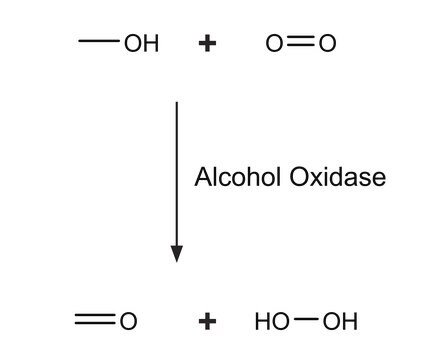
Allgemeine Beschreibung
Anwendung
Biochem./physiol. Wirkung
Physikalische Eigenschaften
Michaelis-Konstante: 4,3 x 10‾5M(Cholesterin)
Inhibitoren: Ionische Reinigungsmittel, Hg++, Ag+
Optimaler pH-Wert: 6,5−7,0
Optimale Temperatur: 45–50 °C
pH-Stabilität: pH 5,0–10,0 (25 °C, 20 h)
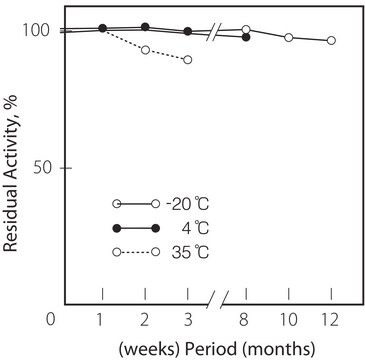
Wärmestabilität: Unter 45 °C (pH 7,0, 15 min)
Einheitendefinition
Physikalische Form
Angaben zur Herstellung
Signalwort
Danger
H-Sätze
P-Sätze
Gefahreneinstufungen
Resp. Sens. 1
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 3
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Persönliche Schutzausrüstung
Eyeshields, Gloves, type N95 (US)
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Protokolle
Protocol for Assay Procedure for Cholesterol Oxidase
This procedure applies to products that have a specification for the enzymatic activity of cholesterol oxidase. This assay is NOT to be used to assay Cholesterol Oxidase from Schizophyllum commune (Discontinued Product Number C7274) and from Brevibacterium sp. (Discontinued Product Number C8153).
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.