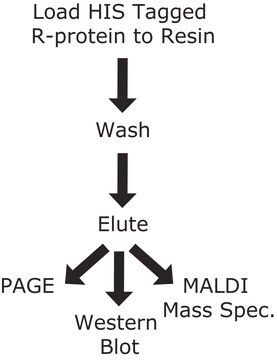
Wichtige Dokumente
COHISR-RO
Roche
cOmplete™ His-Tag-Aufreinigungsharz
suspension, suitable for protein purification, matrix Sepharose-CL 6B
About This Item
Empfohlene Produkte
Form
suspension
Verpackung
pkg of 200 mL (05893801001 [settled resin volume])
pkg of 25 mL (05893682001 [settled resin volume])
Hersteller/Markenname
Roche
Methode(n)
protein purification: suitable
Matrix
Sepharose-CL 6B
Lagertemp.
2-8°C
Verwandte Kategorien
Allgemeine Beschreibung
Bindungskapazität: ≥ 40 mg Protein pro ml Harzbettvolumen. Die Bindungskapazität des Harzes an verschiedene Proteinarten kann je nach Proteineigenschaften, wie z.B. Proteingröße, variieren. cOmplete His-Tag Aufreinigungssäulen binden mit hoher Spezifität an das Polyhistidin-markierte Protein. Daher kann die Bindungskinetik im Vergleich zu konventionellen Metallchelatmatrizen unterschiedlich erscheinen. Die volle Kapazität von cOmplete His-Tag Aufreinigungssäulen kann erzielt werden, indem die Fließrate während des chromatographischen Aufreinigungsverfahrens reduziert und somit ein längere Zeit für die Bindung des Proteins an das Harz gewährt wird.
Maximale lineare Fließrate: 1.420 cm/h
Empfohlene volumetrische Fließrate: Die volumetrische Fließrate ist eine Funktion des Säulenquerschnitts. Eine lineare Fließrate kann anhand der folgenden Formel in eine volumetrische Fließrate (ml/min) umgerechnet werden: Lineare Fließrate (cm/h) × Säulenquerschnittsfläche (cm2)/60. Die Säulenquerschnittsfläche ist definiert als Π× r2, wobei Π die Konstante pi und r der Innenradius der Säule ist.
Empfohlene Imidazolkonzentration für Lade-/Waschpuffer: Die unspezifische Bindung von Proteinen ohne ein His-Tag ist gering. Verwenden Sie bis zu 5 mM Imidazol in Lade- und/oder Waschpuffern. Wenn Sie einen neuen Assay für die Aufreinigung von His-Tag-Proteinen mit cOmplete His-Tag Aufreinigungssäulen etablieren, verwenden Sie kein Imidazol. Wenn zum Beispiel die Reinheit des His-Tag-Proteins nach diesem ersten Schritt verbessert werden muss, verwenden Sie Imidazol in einer Endkonzentration von 5 mM in einem zweiten Schritt.
Empfohlene Imidazolkonzentration für die Elution: Bis zu 500 mM. Bitte beachten Sie: Im Gegensatz zu anderen Harzen auf dem Markt eluiert gebundenes His-markiertes Protein typischerweise aus cOmplete His-Tag Aufreinigungssäulen bei einer geringeren Imidazol-Konzentration (z.B. 25 bis 45 mM).
Kompatibilität für Langzeitlagerung: 20 % Ethanol, pH 4,0 bis pH 9,0
Kompatibilität während der Chromatographie: Das Harz ist kompatibel mit 10 mM EDTA, 10 mM DDT während der Aufreinigung (1 Stunde Inkubation), 6M Guanidinium-HCl, 8M Harnstoff, pH 2,0 bis pH 14,0.
Kompatibilität während der Reinigung: 4 % SDS
Das Harz hält außerdem seine Bindungskapazität bei, gleichgültig ob Sie Proteine mit niedrigem oder hohem Molekulargewicht verwenden, und seine Spezifität ermöglicht eine Aufreinigung in einem Schritt. Durch die Verwendung einer der stärksten Chelatoren auf dem Markt wird eine minimale Kontamination Ihrer Durchflussfraktionen durch Metallionen gewährleistet, und Ihre nachgeschalteten Anwendungen werden geschützt.
Das cOmplete His-Tag Aufreinigungsharz ist auch in einem vorgepackten Format erhältlich: mit 1 ml oder 5 ml Harz.
Anwendung
Die Aufreinigung eines Zielproteins ist oftmals unentbehrlich zur Bestimmung seiner Funktion, Struktur oder Interaktionen, zur Produktion spezifischer Antikörper oder zur Vorbereitung von Enzymen für praktische Anwendungen. Die Isolierung natürlich exprimierter Proteine aus ihrer ursprünglichen Quelle kann ein komplexer Prozess sein, der zahlreiche Chromatographieschritte beinhaltet. Die rekombinante Proteinexpression in spezifischen Wirtsorganismen kann diese Aufgabe erheblich vereinfachen. Solche Expressionssysteme gewährleisten im Allgemeinen einen höheren Expressionsgrad. Auch verleiht die Fusion eines Zielproteins an ein Tag einer Affinitätsmatrix vorteilhafte Bindungsfähigkeiten.
Proteinaufreinigung mit immobilisiertem Ni2+
Die gebräuchlichste Methode bei der Affinitätsaufreinigung von Proteinen beinhaltet den Einbau einer Sequenz von 6 bis 14 Histidinen in das N- oder C-terminale Ende (oder selbst eine freiliegende Schlaufe) des Proteins. Solche Polyhistidin-Abschnitte binden stark an divalente Metallionen wie Nickel und Cobalt. Dieser Effekt kann zur Separation von Proteinen genutzt werden. Metallionen können mithilfe eines Chelators auf einer Matrix immobilisiert werden, wobei das Ion weiterhin mit dem Polyhistidin-Tag des Proteins interferieren kann. Wenn diese His-markierten Proteine durch eine Säule mit immobilisierten Metallionen geleitet werden, binden die Proteine über das Tag an die Säule. Nahezu alle unmarkierten Proteine laufen durch die Säule. Die Freisetzung des Proteins erfolgt durch Elution entweder mit Imidazol, das mit dem Polyhistidin-Tag um die Bindung an die Säule konkurriert, oder durch Herabsetzung des pH-Werts, wodurch die Affinität des Tags für das Harz verringert wird. Während dieses Verfahren allgemein für die Aufreinigung rekombinanter Proteine mit einem konstruierten Affinitäts-Tag eingesetzt wird, kann es auch für natürliche Proteine mit einer inhärenten Affinität für divalente Kationen genutzt werden.
His-Tags
Im Idealfall bindet das His-markierte Zielprotein deutlich stärker an die Ni2+-Chelatmatrix als endogene histidinhaltige Proteine des Expressionswirts. Die relative Bindungsstärke hängt davon ab, wie viele Histidine gleichzeitig an die Matrix binden können (Aviditätseffekt). Längere His-Tags erzielen eine stärkere Bindung und bessere Separation des Zielproteins von potenziell kontaminierenden Wirtsproteinen. Das klassische His-Tag besteht aus sechs fortlaufenden Histidinen. Tags mit 10 bis 14 Histidinen erzielen möglicherweise eine bessere Aufreinigung. Am wichtigsten ist jedoch, dass His-markierte Proteine mit Ni2+-Chelatmatrizen sowohl unter nativen als auch denaturierenden Bedingungen aufgereinigt werden können. Aufgrund ihrer hydrophilen und flexiblen Beschaffenheit erhöhen diese Matrizen die Löslichkeit der Zielproteine und interferieren nur selten mit der Proteinfunktion. Aufgrund der Kombination dieser Eigenschaften ist das His-Tag ein vielseitig einsetzbares Arbeitsmittel für die Proteinaufreinigung.
Leistungsmerkmale und Vorteile
- Wenden Sie die Pufferbedingungen an, die am besten für Ihr Protein geeignet sind: Schaffen Sie optimale Bedingungen für Ihr Protein und richten Sie sich nach Ihrem Protein, nicht nach Ihrem Aufreinigungsharz, wenn Sie bestimmen, ob Sie DTT, EDTA oder andere Puffersubstanzen verwenden.
- Wiederholte Gewinnung von hochreinem Protein: Ein-Schritt-Aufreinigung ohne erneute Harzbeladung.
- Schutz des Proteins vor toxischem Nickel: Reduzierte Proteinoxidation und -aggregation, die durch Nickel abgebende Harze verursacht werden.
- Sicheres und umweltfreundliches Arbeitsumfeld: Keine Handhabung von toxischem Nickel und komplette Elimination von Entsorgungskosten.
Physikalische Form
Sonstige Hinweise
Rechtliche Hinweise
Signalwort
Warning-Warning
H-Sätze
Gefahreneinstufungen
Flam. Liq. 3
Lagerklassenschlüssel
3 - Flammable liquids
WGK
WGK 1
Flammpunkt (°F)
93.2 °F
Flammpunkt (°C)
34 °C
Hier finden Sie alle aktuellen Versionen:
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Artikel
Get maximum protection after protein isolation by using protease and phosphatase inhibitor cocktail tablets from Roche.
Protokolle
cOmplete™ His-Tag Purification Resin Protocol & Troubleshooting
Global Trade Item Number
| SKU | GTIN |
|---|---|
| 5893682001 | 4061838251527 |
| 5893801001 | 4061832635446 |
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.