Alle Fotos(1)
Wichtige Dokumente
BGALA-RO
Roche
β-Glucuronidase/Arylsulfatase
from Helix pomatia
Synonym(e):
Arylsulfatase/β-Glucuronidase, Sulfatase/β-Glucuronidase
Anmeldenzur Ansicht organisationsspezifischer und vertraglich vereinbarter Preise
Alle Fotos(1)
About This Item
UNSPSC-Code:
12352204
Empfohlene Produkte
Biologische Quelle
animal (Helix pomatia)
Qualitätsniveau
Form
solution
Verpackung
pkg of 10 mL (10127698001)
pkg of 2 mL (10127060001)
Hersteller/Markenname
Roche
Methode(n)
ELISA: suitable
Farbe
colorless to brown
Optimaler pH-Wert
4.5-5.0
Löslichkeit
water: miscible
Anwendung(en)
life science and biopharma
sample preparation
Lagertemp.
2-8°C
Verwandte Kategorien
Allgemeine Beschreibung
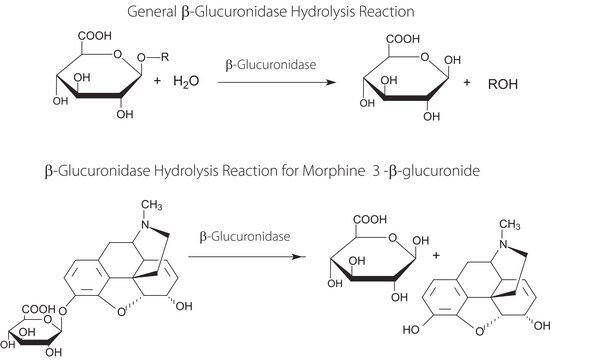
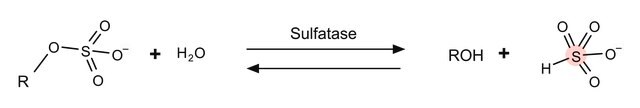
β-Glucuronidase/Arylsulfatase aus Helix pomatiais ist das gebräuchlichste Enzympräparat mit Sulfatase-Aktivität und hat eine sehr breite Spezifität. Es handelt sich dabei um eine grobe Mischung von Enzymen und die Herstellung erfolgt ohne jegliche chromatographische Trennung. Dieses Präparat enthält sowohl Glucuronidase- als auch Sulfataseaktivität. Die enzymatische Hydrolyse vor der Detektion ist ausschlaggebend, um bei der Analyse eine hohe Empfindlichkeit zu erzielen. Nach der Hydrolyse kann die Probe mittels Massenspektroskopie, Gaschromatographie, HPLC oder Immunassay analysiert werden. Bei der Doping-Analyse ist neben der Glucuronidaseaktivität auch die Sulfataseaktivität für den Nachweis aller in der Probe vorhandenen Wirkstoffkonjugate essentiell. β-Glucuronidase/Arylsulfatase wird außerdem für die enzymatische Hydrolyse von Glucuroniden und Sulfatestern in biologischen Flüssigkeiten, hauptsächlich Urin, eingesetzt.
Spezifität
β-Glucuronidase/Arylsulfatase weist eine breite Spezifität für viele verschiedene β-Glucuronide und Sulfatester auf.
Spezifität von β-Glucuronidase:
Die Glycoside, die β-D-Glucuronsäure mit einer Vielzahl von Verbindungen bildet, die Hydroxylgruppen enthalten, hydrolysieren leicht in Gegenwart von β-Glucuronidase.
β-Glucuronidase ist hochspezifisch für den Kohlenhydratanteil: weder α-Glucoside noch β-Glucosiduronsäuren werden hydrolysiert. Die Art des Rückstands von β-Glucuronsäure ist jedoch nur von geringfügiger Bedeutung.
Spezifische Aktivität: 5,5 U/ml bei +38 °C mit Phenolphthalein-β-Glucuronid als Substrat (4,5 U/ml bei +25 °C mit 4-Nitrophenyl-β-D-Glucuronid als Substrat = 100.000 Fishman-Einheiten/ml bei +38 °C mit Phenolphthalein-β-Glucuronid als Substrat). 1 Fishman-Einheit setzt 1 μg Phenolphthalein aus Phenolphthalein-β-Glucuronid in 1 Stunde bei +38 °C frei.
Spezifität von Arylsulfatase:
Die Sulfatester zahlreicher Phenole werden in Gegenwart von Arylsulfatase hydrolisiert. Beispiele dafür sind Steroidsulfate, wie z. B. Estronsulfat, 4-Nitrophenylhydrogensulfat (Km = 1,8 mM, pH 7,3), 4-Nitropyrocatechol-2-sulfat (Km = 1,25 mM, pH 7,5) und Phenolphthaleindisulfat.
Spezifische Aktivität: 2,6 U/ml bei +38 °C mit Phenolphthalein-Disulfat als Substrat (14 U/ml bei +25 °C mit 4-Nitrophenylsulfat als Substrat = 800.000 Roy-Einheiten/ml bei +38 °C mit 2-Hydroxy-5-Nitrophenylsulfat als Substrat). 1 Roy-Einheit setzt 1 μg 2-Hydroxy-5-Nitrophenylsulfat in 1 Stunde bei +38 °C frei.
Spezifität von β-Glucuronidase:
Die Glycoside, die β-D-Glucuronsäure mit einer Vielzahl von Verbindungen bildet, die Hydroxylgruppen enthalten, hydrolysieren leicht in Gegenwart von β-Glucuronidase.
- Zu diesen Verbindungen gehören Steroide, wie z. B. Estriol (Km = 0,42 mM, pH 4,5), Androsteron, Pregnanediol, Tetrahydrocortison,
- Phenole, wie z. B. Phenolphthalein (Km = 0,39 mM), 4-Nitrophenol, 4-Methylumbelliferon,
- Wirkstoffe, wie z. B. Chloramphenicol und Tetrahydrocannabinols,
- und Metaboliten, wie z. B. Thyroxin und Bilirubin.
β-Glucuronidase ist hochspezifisch für den Kohlenhydratanteil: weder α-Glucoside noch β-Glucosiduronsäuren werden hydrolysiert. Die Art des Rückstands von β-Glucuronsäure ist jedoch nur von geringfügiger Bedeutung.
Spezifische Aktivität: 5,5 U/ml bei +38 °C mit Phenolphthalein-β-Glucuronid als Substrat (4,5 U/ml bei +25 °C mit 4-Nitrophenyl-β-D-Glucuronid als Substrat = 100.000 Fishman-Einheiten/ml bei +38 °C mit Phenolphthalein-β-Glucuronid als Substrat). 1 Fishman-Einheit setzt 1 μg Phenolphthalein aus Phenolphthalein-β-Glucuronid in 1 Stunde bei +38 °C frei.
Spezifität von Arylsulfatase:
Die Sulfatester zahlreicher Phenole werden in Gegenwart von Arylsulfatase hydrolisiert. Beispiele dafür sind Steroidsulfate, wie z. B. Estronsulfat, 4-Nitrophenylhydrogensulfat (Km = 1,8 mM, pH 7,3), 4-Nitropyrocatechol-2-sulfat (Km = 1,25 mM, pH 7,5) und Phenolphthaleindisulfat.
Spezifische Aktivität: 2,6 U/ml bei +38 °C mit Phenolphthalein-Disulfat als Substrat (14 U/ml bei +25 °C mit 4-Nitrophenylsulfat als Substrat = 800.000 Roy-Einheiten/ml bei +38 °C mit 2-Hydroxy-5-Nitrophenylsulfat als Substrat). 1 Roy-Einheit setzt 1 μg 2-Hydroxy-5-Nitrophenylsulfat in 1 Stunde bei +38 °C frei.
Spezifität von β-Glucuronidase:
Die Glycoside, die β-D-Glucuronsäure mit einer Vielzahl von Verbindungen bildet, die Hydroxylgruppen enthalten, hydrolysieren leicht in Gegenwart von β-Glucuronidase.
β-Glucuronidase ist hochspezifisch für den Kohlenhydratanteil: weder α-Glucoside noch β-Glucosiduronsäuren werden hydrolysiert. Die Art des Rückstands von β-Glucuronsäure ist jedoch nur von geringfügiger Bedeutung.
Spezifität von Arylsulfatase:
Die Sulfatester zahlreicher Phenole werden in Gegenwart von Arylsulfatase hydrolisiert. Beispiele dafür sind Steroidsulfate, wie z. B. Estronsulfat, 4-Nitrophenylhydrogensulfat (Km = 1,8 mM, pH 7,3), 4-Nitropyrocatechol-2-sulfat (Km = 1,25 mM, pH 7,5) und Phenolphthaleindisulfat.
Die Glycoside, die β-D-Glucuronsäure mit einer Vielzahl von Verbindungen bildet, die Hydroxylgruppen enthalten, hydrolysieren leicht in Gegenwart von β-Glucuronidase.
- Zu diesen Verbindungen gehören Steroide, wie z. B. Estriol (Km = 0,42 mM, pH 4,5), Androsteron, Pregnanediol, Tetrahydrocortison,
- Phenole, wie z. B. Phenolphthalein (Km = 0,39 mM), 4-Nitrophenol, 4-Methylumbelliferon,
- Wirkstoffe, wie z. B. Chloramphenicol und Tetrahydrocannabinols,
- und Metaboliten, wie z. B. Thyroxin und Bilirubin.
β-Glucuronidase ist hochspezifisch für den Kohlenhydratanteil: weder α-Glucoside noch β-Glucosiduronsäuren werden hydrolysiert. Die Art des Rückstands von β-Glucuronsäure ist jedoch nur von geringfügiger Bedeutung.
Spezifität von Arylsulfatase:
Die Sulfatester zahlreicher Phenole werden in Gegenwart von Arylsulfatase hydrolisiert. Beispiele dafür sind Steroidsulfate, wie z. B. Estronsulfat, 4-Nitrophenylhydrogensulfat (Km = 1,8 mM, pH 7,3), 4-Nitropyrocatechol-2-sulfat (Km = 1,25 mM, pH 7,5) und Phenolphthaleindisulfat.
Anwendung
β-Glucuronidase/Arylsulfatase wird verbreitet in Forschungslaboren und analytischen Laboren für die gleichzeitige enzymatische Hydrolyse von Steroid-β-Glucuroniden und Sulfatestern eingesetzt. Das Enzym wird während der Probenvorbereitung zur Abspaltung von Glucuroniden und Sulfatestern vor der GC-MS, HPLC, vor Immunassays oder anderen analytischen Methoden verwendet, einschließlich der Doping-Analyse und Hydrolyse von Steroidkonjugaten (Glucuroniden) und Sulfatestern in Urin und anderen Körperflüssigkeiten.
Leistungsmerkmale und Vorteile
- Entkonjugation und Detektion von sowohl Glucuroniden als auch Sulfatestern.
- Schnelles Screening auf Steroide, Benzodiazepine, Cannabinoide, Opioide und andere Drogen.
Komponenten
EC 2.7.1.1 & 1.1.1.49
Prinzip
Die Glucuronidierung ist ein Grundprinzip des Stoffwechsels. Die meisten Substanzen, die dem menschlichen Körper zugeführt werden, durchlaufen einen Stoffwechselprozess, der die Konjugation mit Glucuronsäure durch UDP-Glucuronosyltransferasen (UGTs) beinhaltet. Dieses Enzym katalysiert den Transfer einer Glucuronylgruppe zu zahlreichen biologisch und pharmakologisch aktiven endogenen und exogenen Molekülen. Glucuronid ist im Allgemeinen besser löslich, weniger giftig und vom menschlichen Körper leichter auszuscheiden als das ursprüngliche Molekül.
Darüber hinaus kann eine Sulfatierung des Wirkstoffes oder der chemischen Substanz durch Sulfotransferasen im menschlichen Körper auftreten. Die Sulfatierung ist im Allgemeinen weniger vorhersagbar als die Glucuronidierung, da es viele Isoenzyme der Sulfotransferasen gibt und individuelle Unterschiede im Verhältnis von Glucuronidierung bzw. Sulfatierung zur Substanz bestehen.
Darüber hinaus kann eine Sulfatierung des Wirkstoffes oder der chemischen Substanz durch Sulfotransferasen im menschlichen Körper auftreten. Die Sulfatierung ist im Allgemeinen weniger vorhersagbar als die Glucuronidierung, da es viele Isoenzyme der Sulfotransferasen gibt und individuelle Unterschiede im Verhältnis von Glucuronidierung bzw. Sulfatierung zur Substanz bestehen.
Einheitendefinition
Glucuronidase:
Standardeinheit
Die Standardeinheit der β-Glucuronidaseaktivität ist die Enzymaktivität, welche die Freisetzung von 4-Nitrophenol aus 4-Nitrophenyl-β-D-Glucuronsäure bei einer Temperatur von +25 °C und einem pH-Wert von 4,5 um 1 μM beschleunigt.
Phenolphthalein-Einheit
Die Phenolphthalein-Einheit der β-Glucuronidaseaktivität ist die Enzymaktivität, welche die Freisetzung von Phenolphthalein aus Phenolphthalein-β-D-Glucuronsäure bei einer Temperatur von +38 °C um 1 μM beschleunigt.
Ungefähr 4,5 Standardeinheiten entsprechen 5,5 Phenolphthalein-Einheiten.
Fishman-Einheit
Die Fishman-Einheit der β-Glucuronidaseaktivität ist die Enzymaktivität, welche die Freisetzung von Phenolphthalein aus Phenolphthalein-β-D-Glucuronsäure bei einer Temperatur von +38 °C um 1 μg beschleunigt.
Ungefähr 1 Standardeinheit entspricht 22.000 Fishman-Einheiten (1 Phenolphthalein-Einheit entspricht 19.000 Fishman-Einheiten).
Arylsulfatase:
Standardeinheit
Die Standardeinheit der Arylsulfataseaktivität ist die Enzymaktivität, welche die Freisetzung von 4-Nitrophenol aus 4-Nitrophenyl-Sulfat bei einer Temperatur von +25 °C und einem pH-Wert von 6,2 um 1 μM beschleunigt.
Phenolphthalein-Einheit
Die Phenolphthalein-Einheit der Arylsulfataseaktivität ist die Enzymaktivität, welche die Freisetzung von Phenolphthalein aus Phenolphthalein-Disulfat bei einer Temperatur von +38 °C und einem pH-Wert von 6,2 um 1 μM beschleunigt.
Ungefähr 5,4 Standardeinheiten entsprechen 1 Phenolphthalein-Einheit.
Roy-Einheit
Die Roy-Einheit der Arylsulfataseaktivität ist die Enzymaktivität, welche die Freisetzung von 4-Nitropyrocatechol aus 2-Hydroxy-5-nitrophenylhydrogensulfat (4-Nitropyrocatechol-2-sulfat) bei einer Temperatur von +38 °C und einem pH-Wert von 6,2 um 1 μg beschleunigt.
Ungefähr 1 Standardeinheit entspricht 57.000 Roy-Einheiten (1 Phenolphthalein-Einheit entspricht 308.000 Roy-Einheiten).
Standardeinheit
Die Standardeinheit der β-Glucuronidaseaktivität ist die Enzymaktivität, welche die Freisetzung von 4-Nitrophenol aus 4-Nitrophenyl-β-D-Glucuronsäure bei einer Temperatur von +25 °C und einem pH-Wert von 4,5 um 1 μM beschleunigt.
Phenolphthalein-Einheit
Die Phenolphthalein-Einheit der β-Glucuronidaseaktivität ist die Enzymaktivität, welche die Freisetzung von Phenolphthalein aus Phenolphthalein-β-D-Glucuronsäure bei einer Temperatur von +38 °C um 1 μM beschleunigt.
Ungefähr 4,5 Standardeinheiten entsprechen 5,5 Phenolphthalein-Einheiten.
Fishman-Einheit
Die Fishman-Einheit der β-Glucuronidaseaktivität ist die Enzymaktivität, welche die Freisetzung von Phenolphthalein aus Phenolphthalein-β-D-Glucuronsäure bei einer Temperatur von +38 °C um 1 μg beschleunigt.
Ungefähr 1 Standardeinheit entspricht 22.000 Fishman-Einheiten (1 Phenolphthalein-Einheit entspricht 19.000 Fishman-Einheiten).
Arylsulfatase:
Standardeinheit
Die Standardeinheit der Arylsulfataseaktivität ist die Enzymaktivität, welche die Freisetzung von 4-Nitrophenol aus 4-Nitrophenyl-Sulfat bei einer Temperatur von +25 °C und einem pH-Wert von 6,2 um 1 μM beschleunigt.
Phenolphthalein-Einheit
Die Phenolphthalein-Einheit der Arylsulfataseaktivität ist die Enzymaktivität, welche die Freisetzung von Phenolphthalein aus Phenolphthalein-Disulfat bei einer Temperatur von +38 °C und einem pH-Wert von 6,2 um 1 μM beschleunigt.
Ungefähr 5,4 Standardeinheiten entsprechen 1 Phenolphthalein-Einheit.
Roy-Einheit
Die Roy-Einheit der Arylsulfataseaktivität ist die Enzymaktivität, welche die Freisetzung von 4-Nitropyrocatechol aus 2-Hydroxy-5-nitrophenylhydrogensulfat (4-Nitropyrocatechol-2-sulfat) bei einer Temperatur von +38 °C und einem pH-Wert von 6,2 um 1 μg beschleunigt.
Ungefähr 1 Standardeinheit entspricht 57.000 Roy-Einheiten (1 Phenolphthalein-Einheit entspricht 308.000 Roy-Einheiten).
Physikalische Form
Lösung in Kochsalzlösung, stabilisiert
Angaben zur Herstellung
Arbeitskonzentration: Bei vielen Anwendungen kann das Produkt unmittelbar vor der Verwendung mit Wasser verdünnt werden oder unverdünnt eingesetzt werden.
Hinweis: Das vorliegende β-Glucuronidase/Arylsulfatase-Präparat ist hochkonzentriert und muss für manche Anwendungen verdünnt werden. Darüber hinaus muss bei der Herstellung von Protoplasten die genaue Konzentration für den jeweiligen Hefestamm empirisch ermittelt werden.
Lagerbedingungen (Arbeitslösung): Hinweis: Aliquote der verdünnten Zubereitung können bei -15 bis -25 °C aufbewahrt werden. Sie sollten nicht mehr als ein oder zwei Mal aufgetaut und wieder eingefroren werden; die Lagerung bei der niedrigeren Temperatur verlängert ihre Haltbarkeit nicht über die des bei 2 bis 8 °C aufbewahrten Produkts hinaus.
Hinweis: Das vorliegende β-Glucuronidase/Arylsulfatase-Präparat ist hochkonzentriert und muss für manche Anwendungen verdünnt werden. Darüber hinaus muss bei der Herstellung von Protoplasten die genaue Konzentration für den jeweiligen Hefestamm empirisch ermittelt werden.
Lagerbedingungen (Arbeitslösung): Hinweis: Aliquote der verdünnten Zubereitung können bei -15 bis -25 °C aufbewahrt werden. Sie sollten nicht mehr als ein oder zwei Mal aufgetaut und wieder eingefroren werden; die Lagerung bei der niedrigeren Temperatur verlängert ihre Haltbarkeit nicht über die des bei 2 bis 8 °C aufbewahrten Produkts hinaus.
Lagerung und Haltbarkeit
Wiederholtes Einfrieren und Auftauen (mehr als 2-mal) vermeiden.
Sonstige Hinweise
Nur für die Life-Science-Forschung. Nicht zur Verwendung in diagnostischen Verfahren vorgesehen.
Lagerklassenschlüssel
12 - Non Combustible Liquids
WGK
nwg
Flammpunkt (°F)
No data available
Flammpunkt (°C)
No data available
Hier finden Sie alle aktuellen Versionen:
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
K Croes et al.
Journal of chromatography. B, Analytical technologies in the biomedical and life sciences, 877(7), 635-644 (2009-02-13)
A liquid chromatography tandem mass spectrometry (LC/MS(n)) method for the determination of 12 corticosteroids in bovine liver has been optimized and validated in accordance with the European Commission Decision 2002/657/EC. A bovine liver sample was deconjugated with beta-glucuronidase/sulfatase enzyme, extracted
Marc Vermeir et al.
Drug metabolism and disposition: the biological fate of chemicals, 37(4), 809-820 (2009-01-10)
Absorption, metabolism, and excretion of darunavir, an inhibitor of human immunodeficiency virus protease, was studied in eight healthy male subjects after a single oral dose of 400 mg of [(14)C]darunavir given alone (unboosted subjects) or with ritonavir [100 mg b.i.d.
Erika Pfeiffer et al.
Carcinogenesis, 26(12), 2172-2178 (2005-07-30)
Soy food has been associated with a reduced incidence of hormonal cancer in Asian countries, and the soy isoflavones daidzein and genistein are believed to protect against tumors induced by the endogenous hormone 17beta-estradiol (E2). In the present study, we
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.