ABN454
Anti-Tau-(T22)-Antikörper, oligomer
serum, from rabbit
Synonym(e):
Microtubule-associated protein tau oligomer, Tau oligomer, PHF-tau oligomer, Paired helical filament-tau oligomer, Neurofibrillary tangle protein oligomer
About This Item
Empfohlene Produkte
Biologische Quelle
rabbit
Qualitätsniveau
Antikörperform
serum
Antikörper-Produkttyp
primary antibodies
Klon
polyclonal
Speziesreaktivität
human
Methode(n)
ELISA: suitable
dot blot: suitable
immunofluorescence: suitable
immunohistochemistry: suitable
immunoprecipitation (IP): suitable
neutralization: suitable
western blot: suitable
NCBI-Hinterlegungsnummer
UniProt-Hinterlegungsnummer
Versandbedingung
wet ice
Posttranslationale Modifikation Target
unmodified
Angaben zum Gen
human ... MAPT(4137)
Allgemeine Beschreibung
Spezifität
Immunogen
Anwendung
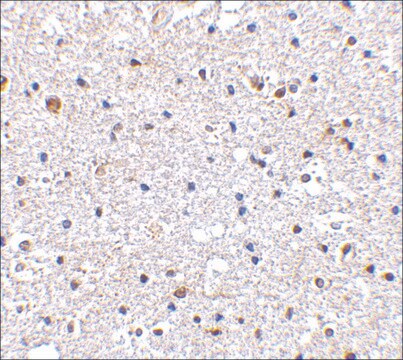
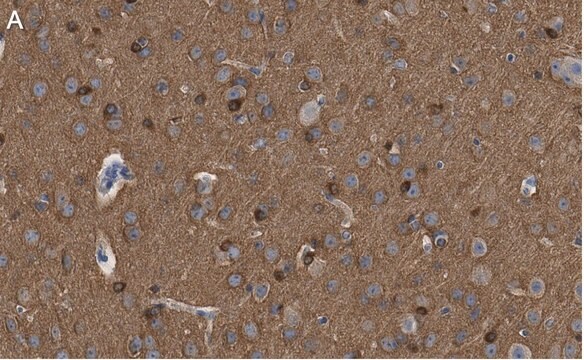
Immunhistochemische Analyse: Mit einer repräsentativen Charge in einer Verdünnung von 1:245–1.000 wurden Tau-Oligomere in der frontalen Großhirnrinde von Patienten mit Alzheimer und Lewy-Körper-Demenz nachgewiesen (mit freundlicher Genehmigung von Prof. Rakez Kayed, University of Texas, Galveston).
Immunfluoreszenz-Analyse: Mit einer repräsentativen Charge wurde oligomeres Tau in Hirngewebeschnitten von Patienten mit chronisch-traumatischer Enzephalopathie (CTE) nachgewiesen. In Hirnschnitten von Patienten ohne CTE zeigte sich jedoch nur eine geringe oder keine Immunreaktivität der Tau-Oligomere. Die Immunreaktivität der Tau-Oligomere wurde mit der von Tau-pThr231 mit einer cis-Konformation, aber nicht mit der von Tau-pThr231 mit einer trans-Konformation zwischen pThr231 und Pro232 kolokalisiert (Kondo, A., et al. (2015). Nature. 523(7561):431–436).
Immunfluoreszenz-Analyse: Mit einer repräsentativen Charge wurde die Immunreaktivität von oligomerem Tau an in Paraffin eingebetteten Frontalkortexschnitten von Alzheimer-Patienten nachgewiesen (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946–1959).
Western-Blot-Analyse: Mit einer repräsentativen Charge in einer Verdünnung von 1:1.000 wurde chronisch-traumatische Enzephalopathie (CTE) in Tau-Aggregat-Lysat nachgewiesen.
Western-Blot-Analyse: Mit repräsentativen Chargen wurde oligomeres Tau aber kein monomeres Tau und keine anderen oligomeren oder fibrillären Proteine nachgewiesen (Wu J.W., et al. (2013). J. Biol. Chem. 288(3):1856–1870; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946–1959).
Dot-Blot-Analyse: Mit einer repräsentativen Charge wurden Tau-Oligomere aber keine Tau-Monomere und keine paarigen helikalen Filamente (Paired Helical Filaments, PHF) nachgewiesen (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946–1959).
ELISA-Analyse: Mit repräsentativen Chargen wurden in-vitro gebildete Tau-Oligomere sowie Tau-Oligomere in PBS-löslichen Gehirnextrakten von Patienten mit progressiver supranukleärer Blickparese (Progressive Supranuclear Palsy, PSP) nachgewiesen (Lasagna-Reeves, C.A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946–1959).
ELISA-Analyse: Mit einer repräsentativen Charge wurde die selektive Reaktivität gegenüber oligomerem Tau bei gleichzeitig deutlich reduzierter Immunreaktivität gegenüber Tau-Fibrillen und keine Reaktivität gegenüber monomerem Tau oder sonstigen Protein-Oligomeren oder -Fibrillen (z. B. Aβ, α-Synuklein oder Insel-Amyloid-Polypeptid) nachgewiesen (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946–1959).
Analyse mittels Immunpräzipitation: Mit einer repräsentativen Charge wurde oligomeres Tau aus Gehirnschnitten von Alzheimer-Patienten, jedoch nicht von Gehirnschnitten von nicht an Alzheimer Erkrankten, ausgefällt (Lasagna-Reeves, C. A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946–1959).
Neutralisationsanalyse: Repräsentative Chargen neutralisierten die Toxizität von oligomerem Tau gegenüber humanen SH-SY5Y-Neuoblastomzellen (Lasagna-Reeves, C. A., et al. (2012). Sci. Rep. 2:700; Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946–1959).
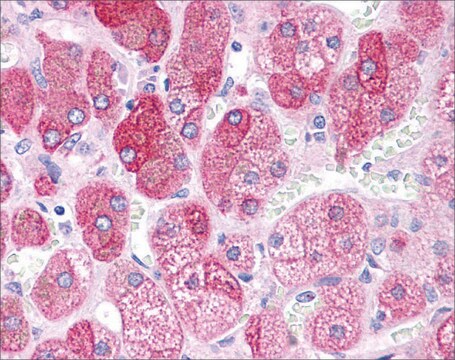
Immunhistochemische Analyse: Mit einer repräsentativen Charge wurde die Immunreaktivität von oligomerem Tau an in Paraffin eingebetteten Gehirnschnitten von Patienten mit progressiver supranukleärer Blickparese (PSP) nachgewiesen (Lasagna-Reeves, C. A., et al. (2012). FASEB J. 26(5):1946–1959).
Neurowissenschaft
Neurodegenerative Erkrankungen
Qualität
Western-Blot-Analyse: Mit einer Verdünnung von 1:1.000 dieses Antikörpers wurden Tau-Oligomere in Hirngewebe-Lysat von Alzheimer-Patienten, jedoch nicht in Lysat von nicht an Alzheimer Erkrankten nachgewiesen.
Zielbeschreibung
Physikalische Form
Lagerung und Haltbarkeit
Handhabungsempfehlungen: Das Fläschchen nach Empfang und vor dem Abnehmen der Kappe zentrifugieren und die Lösung vorsichtig mischen. In Mikrozentrifugenröhrchen aliquotieren und bei -20 °C aufbewahren. Wiederholte Einfrier-/Auftauzyklen sind zu vermeiden, da sie das IgG beschädigen und die Produktleistung beeinträchtigen können.
Haftungsausschluss
Sie haben nicht das passende Produkt gefunden?
Probieren Sie unser Produkt-Auswahlhilfe. aus.
Lagerklassenschlüssel
10 - Combustible liquids
WGK
WGK 1
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.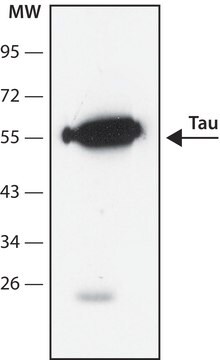

![3-[1,3-Dihydro-4-(5-hydroxy-1-pentyn-1-yl)-1-oxo-2H-isoindol-2-yl]-2,6-piperidinedione ≥95.0%](/deepweb/assets/sigmaaldrich/product/structures/165/184/ebc29f1b-f63f-4e48-afb5-b3aa4c69795a/640/ebc29f1b-f63f-4e48-afb5-b3aa4c69795a.png)