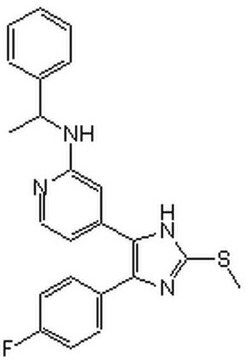
19-134
p38/SAPK2-Inhibitor (SB 202190)
The p38/SAPK2 Inhibitor (SB 202190) controls the biological activity of p38/SAPK2. This small molecule/inhibitor is primarily used for Biochemicals applications.
Anmeldenzur Ansicht organisationsspezifischer und vertraglich vereinbarter Preise
Alle Fotos(1)
About This Item
UNSPSC-Code:
12352200
eCl@ss:
32160405
NACRES:
NA.41
Empfohlene Produkte
Qualitätsniveau
Form
solid
Hersteller/Markenname
Upstate®
Methode(n)
activity assay: suitable (kinase)
NCBI-Hinterlegungsnummer
UniProt-Hinterlegungsnummer
Versandbedingung
wet ice
Anwendung
Der p38/SAPK2-Inhibitor (SB 202190) steuert die biologische Aktivität von p38/SAPK2. Dieser kleine Inhibitor (ein kleines Molekül) wird hauptsächlich in biochemischen Anwendungen eingesetzt.
Wirksamer Inhibitor der p38-alpha/SAPK2a- und p38-beta/SAPK2b-Kinasen.
Biochem./physiol. Wirkung
Inhibitortyp: Kinase
Proteinziel: p38/SAPK2
Ziel-Unterfamilie: CMGC
Qualität
Regelmäßig mittels Kinase-Assay als Inhibitor beurteilt.
Physikalische Form
C20H14FN3O
Lagerung und Haltbarkeit
3 Jahre bei -20 °C
Rechtliche Hinweise
UPSTATE is a registered trademark of Merck KGaA, Darmstadt, Germany
Haftungsausschluss
Sofern in unserem Katalog oder anderen Begleitdokumenten unserer Produkte nicht anders angegeben, sind unsere Produkte nur für Forschungszwecke vorgesehen und nicht für andere Zwecke zu verwenden, einschließlich, jedoch nicht beschränkt auf unautorisierte kommerzielle Verwendung, zur In-vitro-Diagnostik, für Ex-vivo- oder In-vivo-Therapiezwecke oder jegliche Art der Einnahme oder Anwendung bei Menschen oder Tieren.
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 3
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Katsushi Yamamoto et al.
The Journal of biological chemistry, 278(36), 34525-34532 (2003-06-25)
The accumulation of misfolded proteins in the endoplasmic reticulum (ER) evokes the ER stress response. The resultant outcomes are cytoprotective but also proapoptotic. ER chaperones and misfolded proteins exit to the secretory pathway and are retrieved to the ER, during
R M Kramer et al.
The Journal of biological chemistry, 271(44), 27723-27729 (1996-11-01)
The Ca2+-sensitive 85-kDa cytosolic phospholipase A2 (cPLA2) is responsible for thrombin-stimulated mobilization of arachidonic acid for the synthesis of thromboxane A2 in human platelets. We have previously shown that thrombin activates p38 kinase, a recently discovered new member of the
Thrombospondin stimulates focal adhesion disassembly through Gi- and phosphoinositide 3-kinase-dependent ERK activation
Orr, A. W., et al
The Journal of Biological Chemistry, 277, 20453-20460 (2002)
Z Li et al.
Biochemical and biophysical research communications, 228(2), 334-340 (1996-11-12)
We have identified a third member of the p38 group of MAP kinase termed p38 gamma. The cDNA for this MAP kinase encodes an 367 amino acid polypeptide that is slightly greater than 60% identical to p38 and p38 beta.
J C Lee et al.
Nature, 372(6508), 739-746 (1994-12-22)
Production of interleukin-1 and tumour necrosis factor from stimulated human monocytes is inhibited by a new series of pyridinyl-imidazole compounds. Using radiolabelled and radio-photoaffinity-labelled chemical probes, the target of these compounds was identified as a pair of closely related mitogen-activated
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.