Alle Fotos(4)
Wichtige Dokumente
03143422001
Roche
Genopure Plasmid Maxi Kit
kit of for 10 isolations from 30 to 150 ml
Anmeldenzur Ansicht organisationsspezifischer und vertraglich vereinbarter Preise
Alle Fotos(4)
About This Item
UNSPSC-Code:
41105500
NACRES:
NA.55
Empfohlene Produkte
Allgemeine Beschreibung
Für die Herstellung großer Mengen (Maxi) Plasmid-DNA.
Anwendung
Das Genopure Plasmid Maxi-Kit wird für die Herstellung großer Mengen (bis zu 500 μg Plasmid) Plasmid-DNA in Transfektionsgüte aus Bakterienkulturen verwendet. Isoliertes Plasmid eignet sich für die meisten molekularbiologische Anwendungen:
- Transfektion
- Southern Blotting
- Sequenzierung
- PCR/Lange PCR
- Restriktionsverdau
- Klonen
Leistungsmerkmale und Vorteile
Das Genopure Plasmid Maxi-Kit produziert hochreine Plasmid-DNA in in großen Mengen unter Verwendung eines modifizierten alkalischen Lyseverfahrens.
- Gebrauchsfertige Reagenzien sparen viel Zeit.
- Reinigt Plasmide aller Größen und Arten,
- Zur gleichzeitigen Verarbeitung mehrerer Proben können
- Es werden auch keine schädlichen organischen Verbindungen
- Die gewonnene Plasmid-DNA ist wesentlich reiner
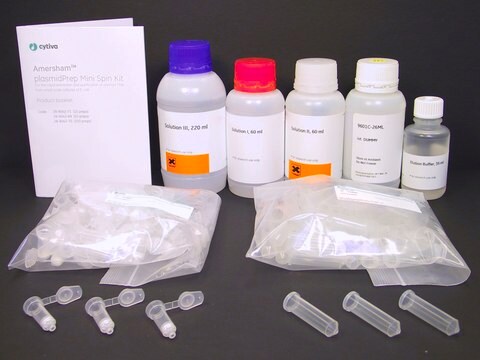
Komponenten
- Suspensionspuffer
- RNase A
- Lysepuffer
- Neutralisierungspuffer
- Äquilibrierungspuffer
- Waschpuffer
- Elutionspuffer
- NucleoBond AX 500 Säulen
- Faltenfilter (240 mm Durchmesser)
- Dichtungsringe
Qualität
Die mit diesem Kit aufgereinigte Plasmid-DNA wurde auf Restriktionsverdau getestet; pUC 19 wurde wie im Protokoll beschrieben aus dem transformierten HB101-Stamm isoliert. 1 μg Plasmid wurde mit 1 Einheit Msp I in 2 Stunden bei +37 °C vollständig verdaut, was mittels Agarosegelanalyse nachgewiesen wurde.
Die Plasmidrückgewinnung wurde mit 250 μg aufgereinigtem Plasmid getestet. Zurückgewonnen wurden >90 %, mit mehr als 80 % davon in Supercoil-Struktur. Die Ausbeute an Plasmid-DNA wurde durch Isolation der PBS aus DH5a-Zellen bestimmt Aus 150 ml Kulturvolumen mit einem A600-Wert zwischen 3 und 6 wurden >400 μg Plasmid-DNA gewonnen.
Die Reinheit (durch das Verhältnis A260/A280 geprüft) beträgt 1,8 + 0,2.
Die RNA-Kontamination wurde mit 3 μg nach dem Standardverfahren aufgereinigter PBS analysiert und mittels Elektrophorese auf Agarosegel geprüft. Es wurde keine RNA nachgewiesen.
Die Kit-Bestandteile wurden gemäß dem aktuellen Qualitätskontrollverfahren auf die Abwesenheit von Nukleasen getestet.
Die Plasmidrückgewinnung wurde mit 250 μg aufgereinigtem Plasmid getestet. Zurückgewonnen wurden >90 %, mit mehr als 80 % davon in Supercoil-Struktur. Die Ausbeute an Plasmid-DNA wurde durch Isolation der PBS aus DH5a-Zellen bestimmt Aus 150 ml Kulturvolumen mit einem A600-Wert zwischen 3 und 6 wurden >400 μg Plasmid-DNA gewonnen.
Die Reinheit (durch das Verhältnis A260/A280 geprüft) beträgt 1,8 + 0,2.
Die RNA-Kontamination wurde mit 3 μg nach dem Standardverfahren aufgereinigter PBS analysiert und mittels Elektrophorese auf Agarosegel geprüft. Es wurde keine RNA nachgewiesen.
Die Kit-Bestandteile wurden gemäß dem aktuellen Qualitätskontrollverfahren auf die Abwesenheit von Nukleasen getestet.
Angaben zur Herstellung
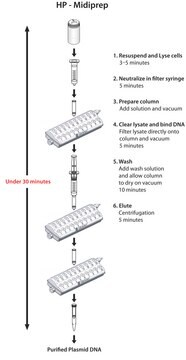
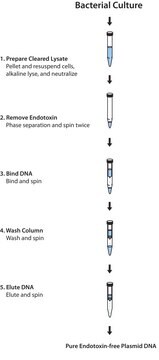
Das Isolationsverfahren basiert auf einem modifizierten alkalischen Lyseprotokoll, das folgende Schritte umfasst: Die Bakterien werden teilweise lysiert, sodass die Plasmid-DNA von der Zellwand in den Überstand entweichen wird. Die größere chromosomale DNA aus E. coli wird in der Zellwand festgehalten. Das Lysat wird mittels Filtration oder Zentrifugation von Zelltrümmern befreit und die Plasma-DNA enthaltende Fraktion wird auf eine voräquilibrierte Säule geladen. Da das geklärte Lysat in einem salzarmen Puffer auf die Säule geladen wird, bindet die DNA an das makroporöse Anionenaustauschmaterial in der Säule. Zelluläre Verunreinigungen werden mittels Hochsalzpuffer (High-Salt-Wash) von der Säule eluiert. Zuletzt wird die Plasmid-DNA von der Säule eluiert. Die zurückgewonnene DNA wird aus dem Eluat ausgefällt, um das Salz zu entfernen und das Plasmid zu konzentrieren.
Hinweis zur Analyse
Probe:
E. coli-Kultur, die Plasmid mit hoher Kopienzahl enthält: 30 bis 150 ml Bakterienkultur
E. coli-Kultur, die Plasmid mit niedriger Kopienzahl enthält: 100 bis 500 ml Bakterienkultur
Plasmidgröße: Das Isolationsverfahren eignet sich für Plasmide aller Größen. Hinweis: Lysate von größeren Konstrukten (bis zu 100 kb) sollten durch Filtration statt durch Zentrifugation geklärt werden, um eine Plasmidabscherung zu verhindern.
Zeitaufwand: 75 Minuten (einschließlich Filtration des Lysats)
Typische Ausbeute:
Plasmid mit hoher Kopienzahl: 3 bis 5 μg/ml Kultur
Plasmid mit niedriger Kopienzahl: 0,2 bis 1 μg/ml Kultur
Produktreinheit: Die isolierte Plasmid-DNA ist frei von anderen Bakterienkomponenten, einschließlich RNA.
E. coli-Kultur, die Plasmid mit hoher Kopienzahl enthält: 30 bis 150 ml Bakterienkultur
E. coli-Kultur, die Plasmid mit niedriger Kopienzahl enthält: 100 bis 500 ml Bakterienkultur
Plasmidgröße: Das Isolationsverfahren eignet sich für Plasmide aller Größen. Hinweis: Lysate von größeren Konstrukten (bis zu 100 kb) sollten durch Filtration statt durch Zentrifugation geklärt werden, um eine Plasmidabscherung zu verhindern.
Zeitaufwand: 75 Minuten (einschließlich Filtration des Lysats)
Typische Ausbeute:
Plasmid mit hoher Kopienzahl: 3 bis 5 μg/ml Kultur
Plasmid mit niedriger Kopienzahl: 0,2 bis 1 μg/ml Kultur
Produktreinheit: Die isolierte Plasmid-DNA ist frei von anderen Bakterienkomponenten, einschließlich RNA.
Sonstige Hinweise
Nur für die Life-Science-Forschung. Nicht für den Einsatz in diagnostischen Verfahren vorgesehen.
Signalwort
Danger
H-Sätze
Gefahreneinstufungen
Eye Dam. 1 - Flam. Liq. 3 - Met. Corr. 1 - Skin Corr. 1
Lagerklassenschlüssel
3 - Flammable liquids
WGK
WGK 1
Flammpunkt (°F)
100.4 °F
Flammpunkt (°C)
38 °C
Hier finden Sie alle aktuellen Versionen:
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Kunden haben sich ebenfalls angesehen
Sharon Yunger et al.
Nature protocols, 8(2), 393-408 (2013-02-22)
Transcription kinetics of actively transcribing genes in vivo have generally been measured using tandem gene arrays. However, tandem arrays do not reflect the endogenous state of genome organization in which genes appear as single alleles. Here we present a robust
Vivian I Bonano et al.
Nature protocols, 2(9), 2166-2181 (2007-09-15)
Imaging technologies are influencing the way we study regulatory processes in vivo. Several recent reports use fluorescence minigenes to image alternative splicing events in living cells and animals. This type of reporter is being used to generate transgenic mice to
Haruka Sato et al.
eLife, 11 (2022-03-16)
Neuronal abundance and thickness of each cortical layer are specific to each area, but how this fundamental feature arises during development remains poorly understood. While some of area-specific features are controlled by intrinsic cues such as morphogens and transcription factors
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.