Allgemeine Beschreibung
Amyloid-Beta-A4-Protein (UniProt: P05067; auch bekannt als ABPP, APPI. APP, APP, Alzheimer-Krankheit-Amyloid-Protein, Amyloid-Vorläuferprotein, Beta-Amyloid-Vorläuferprotein, zerebrales vaskuläres Amyloid-Peptid, CVAP, PreA4, Protease-Nexin-II, PN-II) wird durch das Gen APP (auch bekannt als A4, AD1) (Gen-ID: 351) beim Menschen kodiert. Die Ablagerung von Amyloid-Beta (Ab) ist ein frühes Ereignis in der Pathogenese von Morbus Alzheimer (AD). Ab-Peptide entstehen durch die proteolytische Spaltung des Amyloid-Vorläuferproteins (APP). APPs sind Zelloberflächenproteine, die über Clathrin-beschichtete Vertiefung internalisiert werden. Während der Reifung wandert das unreife APP (N-glykosyliert im endoplasmatischen Retikulum) in den Golgi-Komplex, wo die vollständige Reifung (O-glykosyliert und sulfatiert) stattfindet. Nach der Alpha-Sekretase-Spaltung wird das lösliche APP in den extrazellulären Raum freigesetzt und das C-terminale Ende wird in Endosomen und Lysosomen internalisiert. Die Beta-Sekretase spaltet APP zwischen den Resten Met671 und Asp672 und bildet sAPP-Beta und C99. Nach der Beta-Sekretase-Spaltung erfolgt eine zweite Spaltung am C-Terminus des Ab-Peptids, die Ab von C99 freisetzt. Diese Spaltung erfolgt in der Nähe des Rests 712 des C-Terminus. Die Gamma-Sekretase kann die C-terminale Region entweder an Val711 oder Ile713 spalten, um das kürzere Ab-Peptid (Ab1-40) oder das längere Ab-Peptid (Ab1-42) zu produzieren. Ab1-42 kommt häufiger vor und bildet viel leichter fibrilläre Aggregate als das Peptid Ab1-40. Beta-Amyloid-Peptide sind lipophile Metallchelatoren mit metallreduzierender Wirkung. Bindet flüchtige Metalle wie Kupfer, Zink und Eisen. Kann in vitro Cu2+ und Fe3+ zu Cu+ bzw. Fe2+ reduzieren. Abeta42 ist ein wirksameres Reduktionsmittel als Beta-Amyloid 40. Aus physiologischer Sicht wirkt es auf der Oberfläche von Neuronen, die für das Neuritenwachstum, die neuronale Adhäsion und die Axonogenese relevant sind. Es ist auch an der Zellmobilität und der Regulierung der Transkription durch Protein-Protein-Interaktionen beteiligt und kann die Transkriptionsaktivierung durch Bindung an APBB1-KAT5 fördern.
Spezifität
Klon 2D8 weist das Amyloid-beta-A4-Protein in Neuroblastomzellen von Menschen und Mäusen nach. Er ist gegen ein Epitop innerhalb von 16 Aminosäuren der C-terminalen Region gerichtet.
Immunogen
KLH-konjugiertes lineares Peptid, das 16 Aminosäuren der C-terminalen Region von menschlichem Amyloid-Beta-A4-Protein entspricht.
Anwendung
Anti-Amyloid-Beta-A4-Protein, Klon 2D8, Antikörper, Best.-Nr. MABN2273 ist ein hochspezifischer monoklonaler Ratten-Antikörper, der auf das Amyloid-beta-A4-Protein abzielt und in Immunpräzipitation und Western-Blot getestet wurde.
Forschungskategorie
Neurowissenschaft
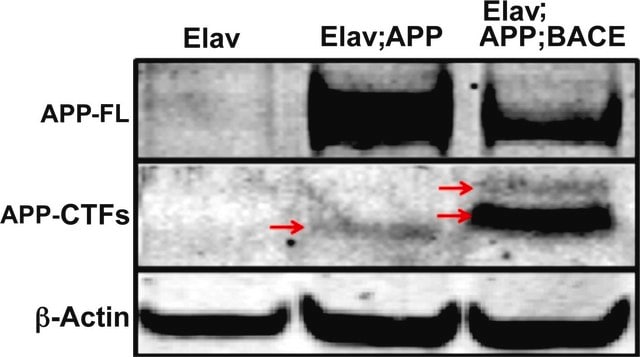
Western-Blot-Analyse: Mit 0,5 ug/ml einer repräsentativen Charge wurde das Amyloid-Beta-A4-Protein in 10 µg N2aA-transfiziertem, N2a-Maus-Neuroblastom- und N2aAB-behandeltem Zelllysat nachgewiesen.
Analyse mittels Immunpräzipitation: Mit einer repräsentativen Charge wurde Amyloid-Beta-A4-Protein in Immunpräzipitationsanwendungen nachgewiesen (Willem, M., et. al. (2015). Nature. 526(7573):443-7).
Western-Blot-Analyse: Mit einer repräsentativen Charge wurde Amyloid-Beta-A4-Protein in Western-Blot nachgewiesen (Willem, M., et. al. (2015). Nature. 526(7573):443-7).
Qualität
Beurteilt mittels Western-Blot an humanem Neuroblastom(Ntera-2)-Lysat.
Western-Blot-Analyse: Mit 0,5 ug/ml dieses Antikörpers wurde das Amyloid-Beta-A4-Protein in 10 µg humanem Neuroblastom(Ntera-2)-Zelllysat nachgewiesen.
Zielbeschreibung
~110 kDa gemessen; 86,94 kDa berechnet. In einigen Lysat(en) können uncharakterisierte Banden beobachtet werden.
Physikalische Form
Aufgereinigter monoklonaler Ratten-Antikörper IgG2b in Puffer mit 0,1 M Tris-Glycin (pH-Wert 7,4), 150 mM NaCl mit 0,05 % Natriumazid.
Format: Aufgereinigt
Über Protein G aufgereinigt
Lagerung und Haltbarkeit
Bei 2–8 °C ab Empfangsdatum 1 Jahr haltbar.
Sonstige Hinweise
Konzentration: Die Konzentration entnehmen Sie bitte dem chargenspezifischen Datenblatt.
Haftungsausschluss
Sofern in unserem Katalog oder anderen Begleitdokumenten unserer Produkte nicht anders angegeben, sind unsere Produkte nur für Forschungszwecke vorgesehen und nicht für andere Zwecke zu verwenden, einschließlich, jedoch nicht beschränkt auf unautorisierte kommerzielle Verwendung, zur In-vitro-Diagnostik, für Ex-vivo- oder In-vivo-Therapiezwecke oder jegliche Art der Einnahme oder Anwendung bei Menschen oder Tieren.