219373
Cathepsin G, humanes Neutrophil
Cathepsin G, Human Neutrophil, CAS 107200-92-0, is a purified native cathepsin G. Acts as a potent agonist of human platelet activation leading to their aggregation.
Synonym(e):
Cathepsin G, humanes Neutrophil
About This Item
Empfohlene Produkte
Biologische Quelle
human neutrophils
Qualitätsniveau
Beschreibung
Merck USA index - 14, 1905
Assay
≥95% (SDS-PAGE)
Form
lyophilized solid (Salt-free)
Spezifische Aktivität
≥2 units/mg protein
Hersteller/Markenname
Calbiochem®
Lagerbedingungen
OK to freeze
Methode(n)
inhibition assay: suitable
Eignung
suitable for molecular biology
Anwendung(en)
life science and biopharma
Versandbedingung
ambient
Lagertemp.
−20°C
Angaben zum Gen
human ... CTSG(1511)
Allgemeine Beschreibung
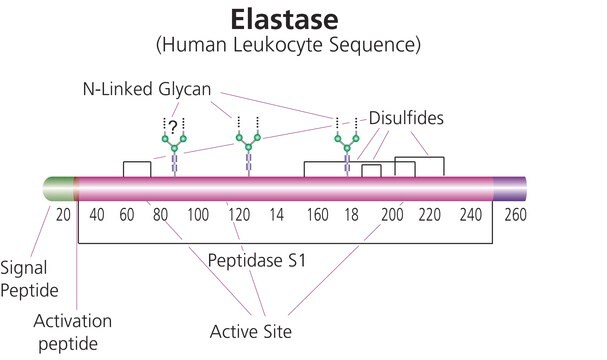
Cathepsin G wird in seiner aktiven Form in azurophilen Granula von Neutrophilen oder Monozyten gespeichert. Seine reife Form enthält eine potenzielle Glykanbindungsstelle und drei Disulfidbindungen.
Anwendung
Biochem./physiol. Wirkung
Warnhinweis
Einheitendefinition
Angaben zur Herstellung
In 150 mmol/l NaCl, 50 mmol/l Natriumacetatpuffer, pH-Wert 5,5, rekonstituieren.
Rekonstituierung
Sonstige Hinweise
Shamamian, P., et al. 2001. J. Cell Physiol.189, 197.
Groutas, W.C., et al. 1993. Biochem. Biophys. Res. Commun.197, 730.
Stone, P.J., et al. 1993. Biochem. Biophys. Res. Commun.197, 130.
Groutas, W.C., et al. 1992. Arch. Biochem. Biophys.294, 144.
Maison, C.M., et al. 1991. J. Immunol.147, 921.
Travis, J. 1988. Am. J. Med.84, 37.
Rechtliche Hinweise
Lagerklassenschlüssel
11 - Combustible Solids
WGK
WGK 3
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.