62970
Lysozyme from chicken egg white
dialyzed, lyophilized, powder, ~100000 U/mg
Synonyme(s) :
Mucopeptide N-acétylmuramoylhydrolase, Muramidase
About This Item
Produits recommandés
Source biologique
chicken egg white
Niveau de qualité
Forme
powder
Qualité
dialyzed
lyophilized
Activité spécifique
~100000 U/mg
Poids mol.
single-chain 14.3 kDa
Mr ~14600
Technique(s)
cell based assay: suitable
Adéquation
suitable for cell lysis
Numéro d'accès UniProt
Application(s)
cell analysis
Température de stockage
2-8°C
Informations sur le gène
chicken ... LYZ(396218)
Vous recherchez des produits similaires ? Visite Guide de comparaison des produits
Application
- as a standard in small-angle neutron scattering experiments and infrared absorbance spectroscopy
- as a constituent of cell lysis buffer
- in protein crystallization experiments
Actions biochimiques/physiologiques
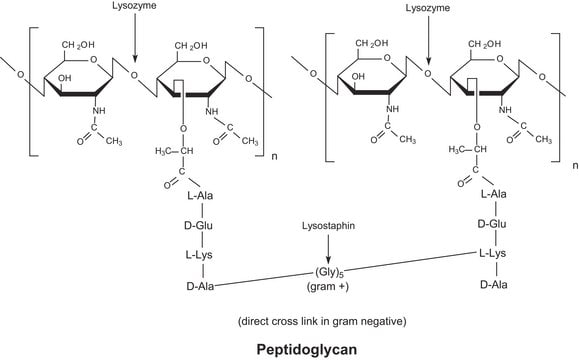
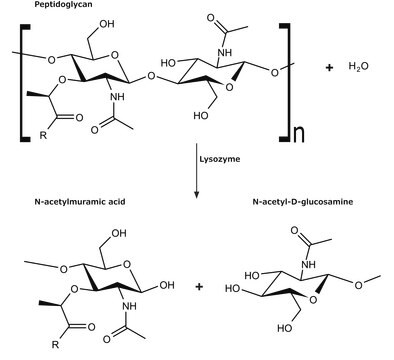
L′enzyme est active dans une vaste gamme de pH (de 6,0 à 9,0). À pH 6,2, une activité maximale est observée sur une plus vaste plage de forces ioniques (de 0,02 à 0,100 M) qu′à pH 9,2 (0,01 à 0,006 M).
Définition de l'unité
Autres remarques
Mention d'avertissement
Danger
Mentions de danger
Conseils de prudence
Classification des risques
Resp. Sens. 1
Code de la classe de stockage
11 - Combustible Solids
Classe de danger pour l'eau (WGK)
WGK 3
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Équipement de protection individuelle
Eyeshields, Gloves, type N95 (US)
Faites votre choix parmi les versions les plus récentes :
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Les clients ont également consulté
Articles
Separation of Ribonuclease A from bovine pancreas, Type I-A, powder, ≥60% RNase A basis (SDS-PAGE), ≥50 Kunitz units/mg protein; α-Chymotrypsinogen A from bovine pancreas, essentially salt-free, lyophilized powder; Cytochrome c from bovine heart, ≥95% based on Mol. Wt. 12,327 basis; Lysozyme from chicken egg white, lyophilized powder, protein ≥90 %, ≥40,000 units/mg protein
Separation of Ribonuclease A from bovine pancreas, Type I-A, powder, ≥60% RNase A basis (SDS-PAGE), ≥50 Kunitz units/mg protein; α-Chymotrypsinogen A from bovine pancreas, essentially salt-free, lyophilized powder; Cytochrome c from bovine heart, ≥95% based on Mol. Wt. 12,327 basis; Lysozyme from chicken egg white, lyophilized powder, protein ≥90 %, ≥40,000 units/mg protein
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique