162663
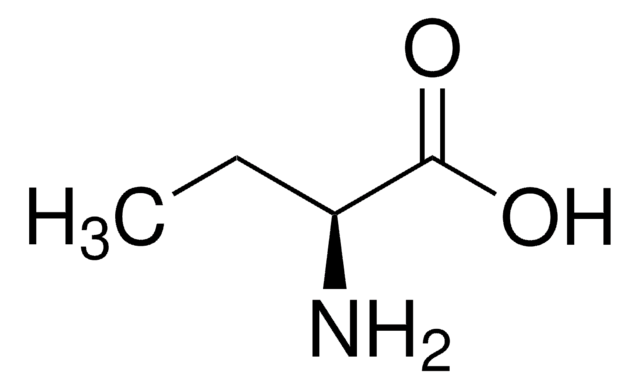
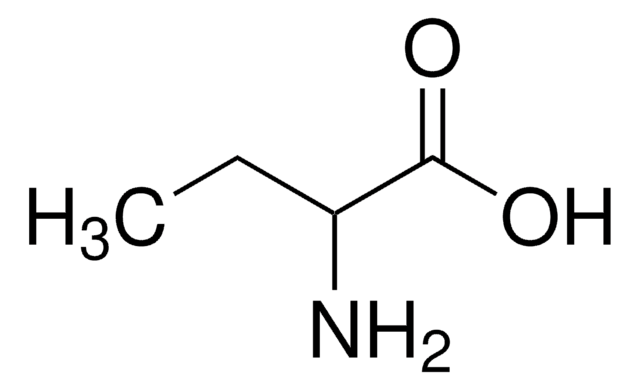
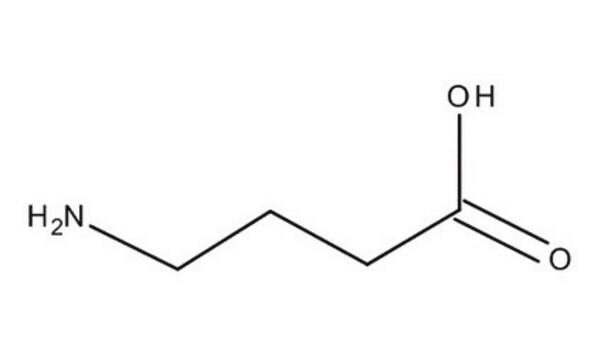
DL-2-Aminobutyric acid
99%, for peptide synthesis, ReagentPlus®
Synonyme(s) :
AABA, Homoalanine, alpha-amino-n-butyric acid
About This Item
Produits recommandés
Nom du produit
DL-2-Aminobutyric acid, ReagentPlus®, 99%
Niveau de qualité
Gamme de produits
ReagentPlus®
Essai
99%
Forme
solid
Capacité de réaction
reaction type: solution phase peptide synthesis
Pf
291 °C (dec.) (lit.)
Application(s)
peptide synthesis
Chaîne SMILES
CCC(N)C(O)=O
InChI
1S/C4H9NO2/c1-2-3(5)4(6)7/h3H,2,5H2,1H3,(H,6,7)
Clé InChI
QWCKQJZIFLGMSD-UHFFFAOYSA-N
Vous recherchez des produits similaires ? Visite Guide de comparaison des produits
Description générale
Application
Informations légales
Code de la classe de stockage
11 - Combustible Solids
Classe de danger pour l'eau (WGK)
WGK 3
Point d'éclair (°F)
Not applicable
Point d'éclair (°C)
Not applicable
Équipement de protection individuelle
Eyeshields, Gloves, type N95 (US)
Faites votre choix parmi les versions les plus récentes :
Déjà en possession de ce produit ?
Retrouvez la documentation relative aux produits que vous avez récemment achetés dans la Bibliothèque de documents.
Les clients ont également consulté
Notre équipe de scientifiques dispose d'une expérience dans tous les secteurs de la recherche, notamment en sciences de la vie, science des matériaux, synthèse chimique, chromatographie, analyse et dans de nombreux autres domaines..
Contacter notre Service technique